自噬是一种进化保守的代谢过程,一是降解和重新利用胞质、长寿命和聚集的蛋白质、多余的或有缺陷的细胞器,二是对照射应激、化疗事件、饥饿、生长因子缺乏、缺氧或病毒感染等情况下所做出的反应。自噬是促进肿瘤细胞生存还是促进细胞死亡取决于许多因素,包括肿瘤细胞的基因型和表型、应激因素、凋亡机制的状态[1]。在电离辐射中,通过其细胞毒性作用可以使肿瘤得到控制。自噬在某些情况下,可以提高肿瘤的辐射敏感性[2],而在另外一些情况下,却提高了肿瘤的辐射抵抗性[3]。目前,对自噬在辐射中所起的作用还存在争议。
PI3K/Akt/mTOR信号轴被广泛地公认为癌症细胞存活和抵抗治疗药物的一种关键介体。自噬调控中的核心分子是哺乳动物雷帕霉素靶蛋白(mTOR)[4, 5],mTOR的失活已被证明启动了自噬,雷帕霉素是mTOR抑制剂[6],在体外,雷帕霉素通过多种机制,包括自噬途径,增加了辐射细胞毒性[7],提示雷帕霉素可以诱导肿瘤细胞发生自噬,并可能增加肿瘤细胞对辐射的敏感性。
本研究以人结肠癌SW480细胞系为研究对象,观察重离子12C6+与X射线诱导人结肠癌细胞SW480发生自噬的情况,分析自噬对SW480细胞侵袭能力、迁移能力和细胞活性的影响,初步探讨了辐射中自噬的作用机制,为肿瘤辐射治疗提供新的实验依据。
1.试剂与仪器:DMEM/F12培养液(美国Hyclone公司);无支原体胎牛血清(杭州四季青公司);0.25%胰蛋白酶(上海雅心公司);青、链霉素(苏州拜吉氏公司);Rapamycin(江苏碧云天研究所);四甲基偶氮唑盐(MTT)(北京Solarbio公司);氯喹、单丹磺酰尸胺(MDC)、LC3B抗体(美国Sigma公司)。Transwell小室(美国Millipore公司);Model680型酶联免疫检测仪(美国Bio-Rad公司);流式细胞仪(美国Bio-Rad公司);Precise医用直线加速器(瑞典医科达公司);兰州重离子加速器HIRFL-CSR(中国科学院近代物理研究所)。
2.细胞培养及分组:SW480人结肠癌细胞系,购于中国科学院上海生命科学研究院细胞库,常规培养于含有100 U/ml青霉素、100 μg/ml链霉素和16%胎牛血清的DMEM/F12培养液中,置于37℃、5% CO2及饱和湿度的细胞培养箱中培养。每1~2天换液1次,3~4 d用胰酶消化传代。实验分为对照组、单纯照射组、照射联合雷帕霉素处理组、照射联合氯喹处理组;其中,照射又分为4 Gy X射线和4 Gy重离子12C6+照射两种方式。雷帕霉素的处理浓度为10 nmol/L,氯喹的处理浓度为50 μmol/L。
3.电镜观察自噬体:各组细胞用胰酶进行消化,离心半径为60 mm,1 500 r/min,离心5 min,弃去上清液后PBS洗3次,每次5 min。2.5%戊二醛4℃固定1 h,1%锇酸4℃后固定1 h,制备成凝胶状。乙醇梯度脱水,氧化丙稀浸泡,环氧树脂包埋并制作成切片。用醋酸双氧铀及柠檬酸铅联合染色,透射电镜观察自噬体。
4.荧光显微镜观察自噬囊泡:每组细胞分别以16×104的密度接种于6孔板中培养2 d,弃净培养液,向每孔中加入1 ml的50 μmol/L的MDC,置于培养箱中孵育1 h,PBS洗3次,每次5 min,4%多聚甲醛固定15 min,PBS洗3次,每次5 min。荧光显微镜进行观察。
5.免疫印迹分析:用胰蛋白酶消化收集各组SW480细胞,加裂解液提蛋白,使用Bradford法测定蛋白含量,取适量样本进行SDS-PAGE电泳分离,之后将蛋白转移至聚偏二氟乙烯(PVDF)膜。5%脱脂奶粉封闭1.5 h,一抗LC3 B(1∶2 500)结合4℃过夜。TBS-T洗3次,每次10 min,与二抗(1∶5 000)结合室温下孵育1 h。TBS-T清洗后经Odyssey红外线成像系统检测。
6.Transwell小室实验:将Transwell小室置于24孔板中,小室上层加入100 μl的Ⅳ型胶原,置于37℃、5%CO2培养箱中聚合30 min,吸取小室上层多余液体,置于超净工作台中风干1.5 h。于下室中加入500 μl完全培养液。细胞用胰蛋白酶消化并吹打成单细胞悬液,细胞计数。于每个上室内加入细胞悬液300 μl(含6×105细胞),置于培养箱中孵育24 h,取出小室,拭去未穿膜细胞,PBS洗3次,4%多聚甲醛固定30 min,超纯水洗3遍,吹干;0.1%结晶紫染色30 min,超纯水洗去浮色;吹干;显微镜下观察拍片。在400倍光镜下随机选取5个视野,计算穿膜到达下室的细胞数,各实验组重复3次,并进行统计。
7.划痕实验:细胞以50×104/孔接种于6孔板内,置于培养箱中培养36 h,取出6孔板,用1 ml枪头划出尽量竖直的划痕。PBS冲洗3次以弃掉划出的细胞。之后按照实验分组进行相应处理。辐射与雷帕霉素或氯喹的联合处理组每孔中加入2.5 ml的DMEM培养液,其中培养液需含有10 nmol/L雷帕霉素或50 μmol/L氯喹且另含5%胎牛血清,37℃、5%CO2条件下培养48 h。100倍荧光显微镜观察,测量划痕条带的宽度。在不同水平线上重复测量3次。每组测量的条带宽度值与相应的对照组进行相比,即得出每组的迁移倍数。
8. MTT法检测细胞存活率:取对数生长期的细胞,胰蛋白酶消化、吹散,按照104/孔细胞密度接种于96孔培养板中,置于培养箱中培养24 h,每组设5个复孔,之后按照实验分组进行相应处理。其中联合处理组中分别加入10 nmol/L的雷帕霉素和50 μmol/L的氯喹。设不加细胞组为空白对照孔,继续培养48 h后,向每个孔内分别加入25 μl的浓度为5 mg/ml的MTT溶液,培养5 h,弃去上清液,每孔内加200 μl的DMSO溶液,经摇床振荡15 min,溶解紫色结晶后,用酶标仪测量A490值。细胞生长抑制率按如下公式计算:抑制率(%)=(1-实验组A490/对照组A490)×100%,各组重复3次。
9.统计学处理:数据用 ±s表示,应用SPSS 19.0统计软件进行分析。各组之间比较均采用方差分析。P<0.05为差异有统计学意义。
±s表示,应用SPSS 19.0统计软件进行分析。各组之间比较均采用方差分析。P<0.05为差异有统计学意义。
1.透射型电子显微镜观察SW480细胞超微结构的变化:与对照组相比,经X射线或重离子照射处理的SW480细胞胞质内出现了双层膜状结构,大小不一,即自噬体;高剂量组的数量多于低剂量组,说明X射线和重离子辐射均能诱导SW480细胞发生自噬。
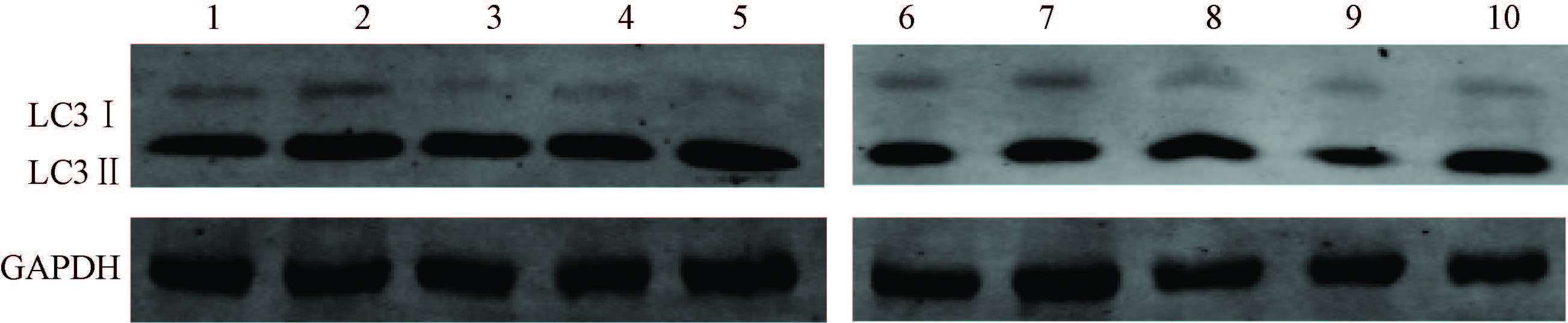
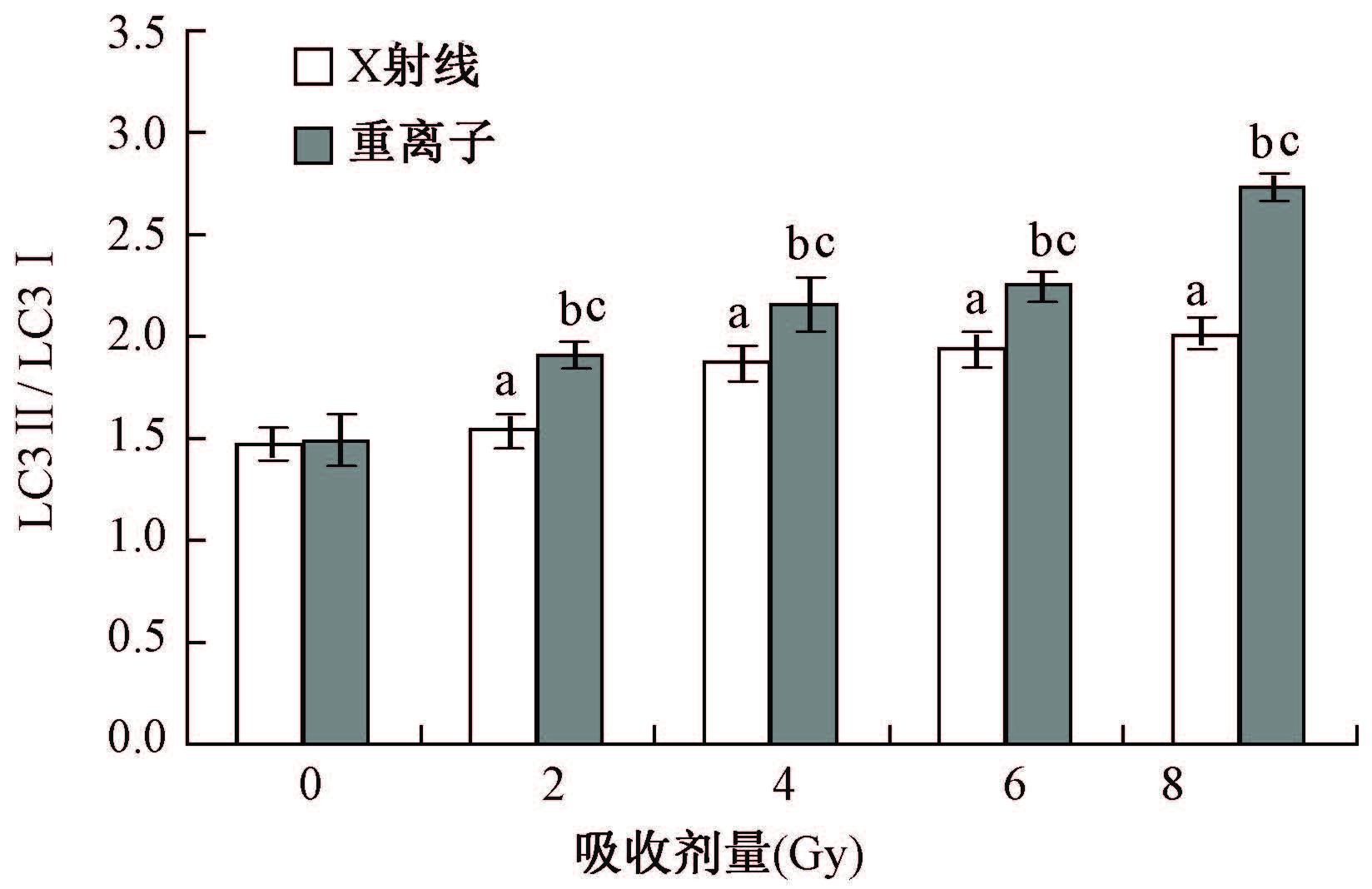
2.免疫印迹法检测自噬相关蛋白:随着X射线或重离子辐射剂量的增加,LC3Ⅰ向LC3Ⅱ转化的水平增加,具有剂量依赖性。同一照射剂量重离子组的LC3Ⅱ/ LC3Ⅰ比例高于X射线组(F=458.526,P<0.05),说明重离子照射发生自噬的水平高于X射线照射(图1,2)。
|
注:1.X射线对照组; 2. 2 Gy X射线照射组; 3.4 Gy X射线照射组; 4.6 Gy X射线照射组; 5.8 Gy X射线照射组; 6.重离子对照组; 7.2 Gy重离子照射组; 8.4 Gy重离子照射组; 9. 6 Gy重离子照射组; 10. 8 Gy重离子照射组 图1 LC3蛋白在不同吸收剂量处理组中的表达 |
|
注:a与X射线对照(0 Gy)组相比,F=189.393,P<0.05;b与重离子对照(0 Gy)组相比,F=1 307.059,P<0.05;c与同一剂量X射线组相比,F=458.526,P<0.05 图2 LC3蛋白在不同吸收剂量处理组中表达情况的LC3Ⅱ/ LC3Ⅰ定量分析 |
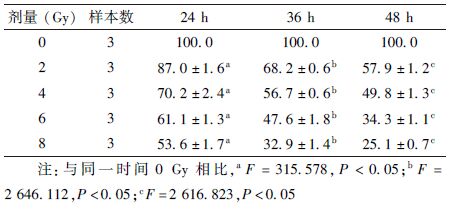
3. X射线照射对SW480细胞增殖的影响:随着X射线辐射剂量的增加以及作用时间的延长,SW480细胞的相对增值率明显降低,X射线辐射抑制SW480细胞的增殖具有剂量-时间依赖性,且差异具有统计学意义(F=2 616.823,P<0.05),见表1。SW480细胞在X射线辐射后48 h即可到达半数抑制,其半数抑制浓度(IC50)为4 Gy。为了便于与重离子辐射对比,后续实验两种射线均选择4 Gy的剂量和48 h作用时间。
表1 不同剂量X射线照射后不同时间对SW480细胞增殖的影响(%,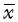 ±s) ±s)
|
4.免疫荧光显微镜观察自噬泡:MDC能够被SW480细胞所吸收,并积聚在自噬囊泡中,胞核周围的胞质内可以观察到蓝绿色散在的点状结构,即说明发生了自噬。将带有黄绿色点状结构的细胞称之为MDC阳性细胞。在对照组细胞中,仅可以见到少量的MDC阳性细胞;与对照组相比,照射组MDC阳性细胞增加;而照射联合雷帕霉素处理组MDC阳性细胞明显增加;与照射组相比,辐射联合氯喹处理组MDC阳性细胞有所减少。重离子组的MDC阳性细胞数量多于相应的X射线处理组(图3)。
|
图3 荧光显微镜观察自噬囊泡 MDC染色 ×40 A.X射线对照组; B.4 Gy X射线照射组; C.4 Gy X射线联合雷帕霉素处理组48 h; D.4 Gy X射线联合氯喹处理组48 h; E.重离子对照组; F.4 Gy重离子照射组; G.4 Gy重离子联合雷帕霉素处理组48 h; H.4 Gy重离子联合氯喹处理组48 h |
5.透射电镜观察SW480细胞超微结构的变化:与照射组相比,照射联合雷帕霉素处理组的自噬体数量明显增加;辐射联合氯喹处理组的自噬体数量有所减少;重离子组的自噬体数量多于相应的X射线处理组(图4)。

|
注:N.细胞核;AV.自噬体;n.核仁 图4 透射电镜观察SW480细胞的超微结构 ×1 000 A.X射线对照组; B.4 Gy X射线照射组; C.4 Gy X射线联合雷帕霉素处理组48 h; D.4 Gy X射线联合氯喹处理组48 h; E.重离子对照组; F.4 Gy重离子照射组; G.4 Gy重离子联合雷帕霉素处理组48 h;H.4 Gy重离子联合氯喹处理组48 h |
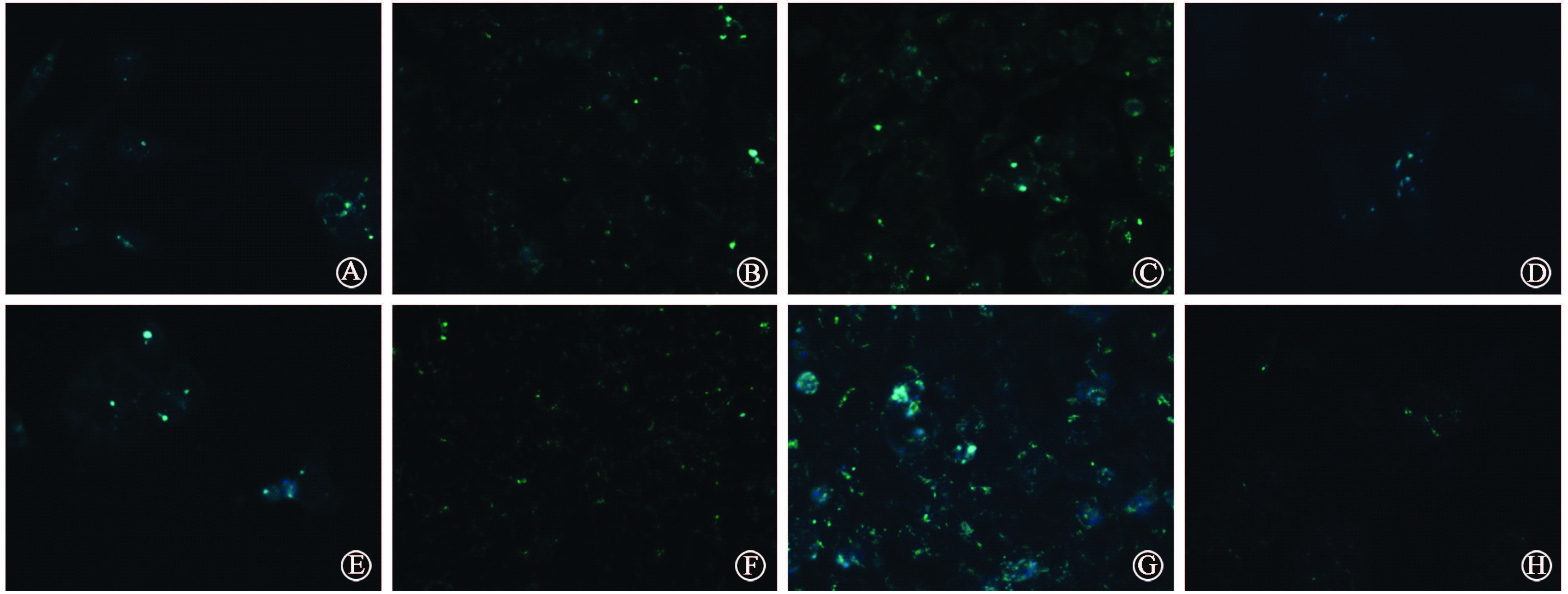
6.辐射诱导的自噬与SW480细胞侵袭能力的关系:结果如图5所示。与空白对照组相比,单纯照射组穿膜细胞数量减少(F=194.692,P<0.05);照射联合雷帕霉素组穿膜细胞数量明显减少(F=194.692,P<0.05);与单纯照射组相比,照射联合氯喹组穿膜细胞数量增加(F=194.692,P<0.05)。与X射线单纯照射组、X射线联合雷帕霉素组比较,重离子单纯照射组、重离子联合雷帕霉素组穿膜细胞数量更少(F=256.800,P<0.01)。
|
注:a与X射线空白对照组相比,F=194.692,P<0.05;b与重离子空白对照组相比,F=851.000,P<0.05;c与同一剂量或药物X射线组相比,F=256.800,P<0.01 图5 两种射线单纯照射与联合雷帕霉素及氯喹对SW480细胞侵袭能力的影响 |
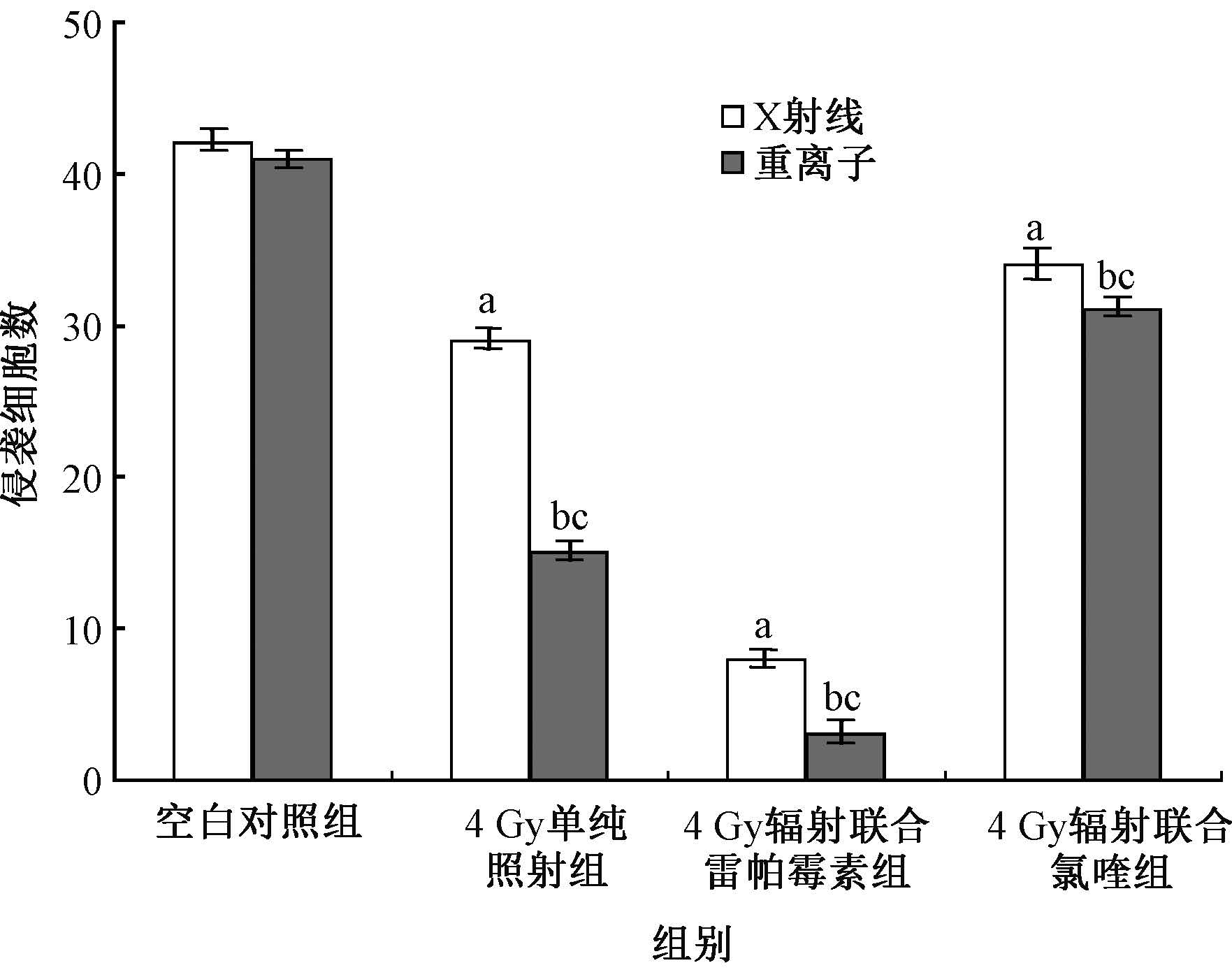
7.辐射诱导的自噬与结肠癌SW480细胞迁移能力的关系:划痕实验结果显示,与对照组相比,照射组SW480细胞向划痕处迁移减弱,划痕较宽;照射联合雷帕霉素组SW480细胞向划痕处迁移显著减慢,划痕明显增宽;与单纯照射组相比,照射联合氯喹组SW480细胞向划痕处迁移有所增强,划痕缩窄。与X射线单纯照射组、X射线联合雷帕霉素组相比较,重离子单纯照射组、重离子联合雷帕霉素组的划痕更宽(F=636.612,P<0.01)(图6,7)。

|
图6 辐射、雷帕霉素及氯喹与SW480细胞迁移能力的关系 ×10 A.X射线对照组; B.4 Gy X射线照射组; C.4 Gy X射线联合雷帕霉素48 h组; D.4 Gy X射线联合氯喹48 h组; E.重离子对照组; F.4 Gy重离子照射组; G.4 Gy重离子联合雷帕霉素48 h组; H.4 Gy重离子联合氯喹48 h组 |
|
图7 划痕条带宽度定量分析 注:a与X射线空白对照组相比,F=629.917,P<0.05; b与重离子空白对照组相比,F=789.667,P<0.05; c与同一剂量或药物X射线组相比,F=636.612,P<0.01 |
8.辐射诱导的自噬对细胞增殖的影响:与对照组相比,辐射处理组的细胞活性轻度下降(F=302.903,P<0.05),辐射联合雷帕霉素,细胞活性显著下降(F=302.903,P<0.05),辐射联合氯喹,细胞活性有所增强(F=302.903,P<0.05)。与X射线单纯照射组、X射线联合雷帕霉素组比较,重离子单纯照射组、重离子联合雷帕霉素组细胞活性下降更多(F=228.235,P<0.01),见图8。
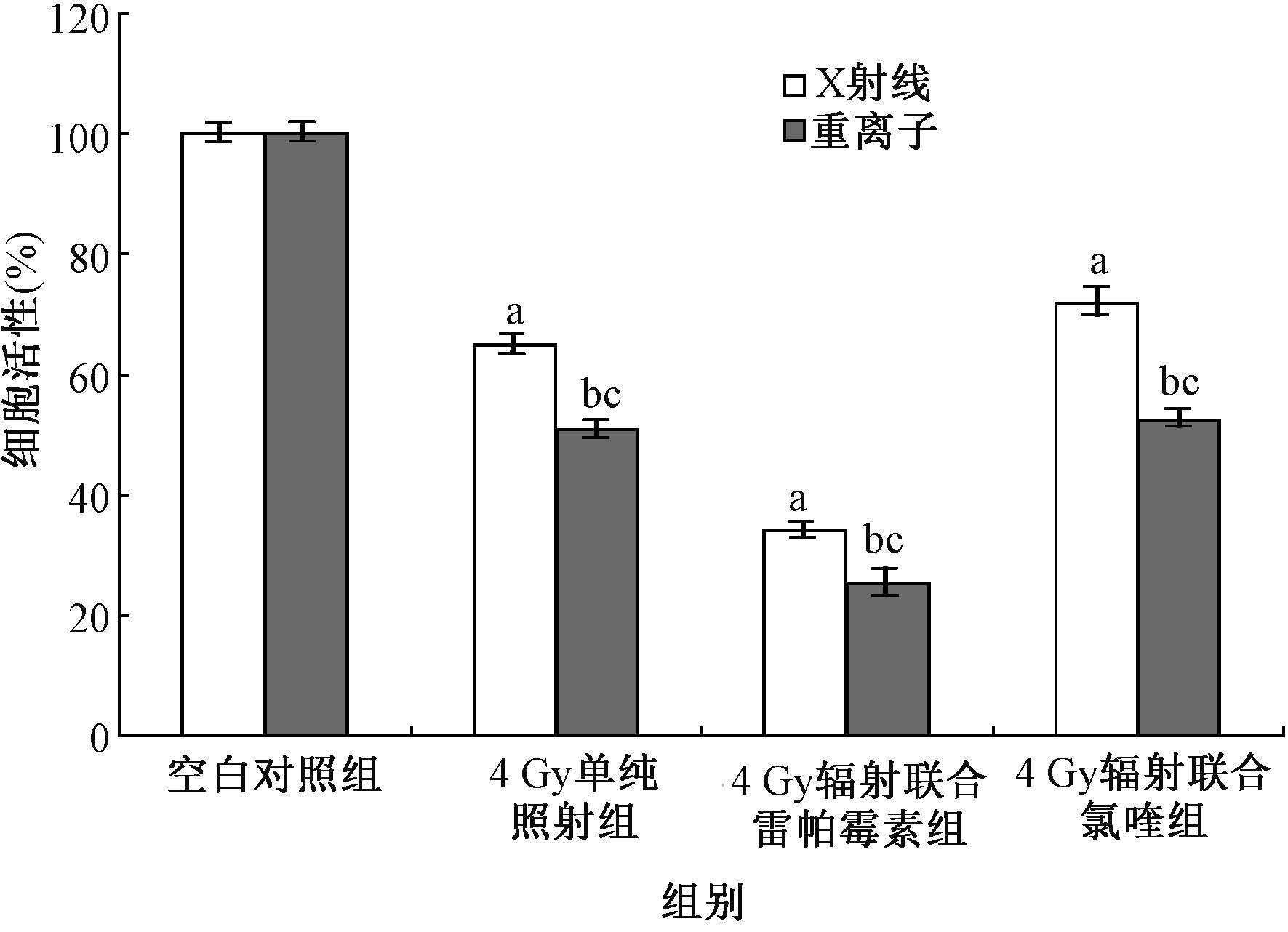
|
图8 两种射线照射及联合雷帕霉素、氯喹对细胞活性的影响 注:a与X射线空白对照组相比,F=302.903,P<0.05; b与重离子空白对照组相比,F=9 101.387,P<0.05; c与同一剂量或药物X射线组相比,F=228.235,P<0.01 |
自噬是一个高度保守的代谢过程,其关键的功能是保持在正常生长条件下维持细胞内环境稳定和在应激条件下保存细胞活力之间的平衡。细胞“消化自身”涉及到双膜泡的自噬体,随后在溶酶体内进行降解,从而回收能量并重新构建新的生物分子的合成[8]。细胞自噬是一个重要的代谢过程,自噬起着降解和回收长寿命蛋白质、细胞聚集、受损的细胞器的作用[9]。自噬的基础水平对细胞的生存是必须的,以抗细胞应力[10]。在压力过大的情况下,伴随着完全的自我消化降解,自噬也作为一个自杀途径,其被归类为Ⅱ型程序性细胞死亡。通过调节自噬用于癌症的预防和治疗,并作为抗癌药物研发的一个靶点[9]。
自噬在细胞中发挥着促进细胞死亡和生存的双重作用,这取决于自噬激活的程度、种类和损害的持续时间[11]。在HT-29和HCT-116结肠癌细胞中,硫化氢所诱导的自噬抑制了HT-29和HCT-116结肠癌细胞的增殖,自噬对细胞起着杀伤作用[12]。Lee等[13]的研究认为,ROS诱导了自噬的激活,伴随有HCT-116细胞的死亡,自噬对细胞也起着杀伤作用。而同样在HCT-116结肠癌细胞中,Chaachouay等[14]的研究认为,中度缺氧诱导了自噬,但也增加了HCT-116细胞的抵抗性,说明自噬对细胞起保护作用。在CT26结肠癌细胞中,ART1促进了饥饿所诱导的自噬;抑制ART1可起到辅助杀伤癌细胞的作用、抑制了癌细胞的生长,自噬起保护作用[15]。由此可知,自噬可能在不同肿瘤细胞中发挥着不同作用。在本实验中,辐射诱导的自噬对癌细胞起杀伤作用。
辐射能够诱导肿瘤细胞发生自噬[16, 17, 18],本实验研究的辐射源选择了两种,一种是医用加速器产生的X射线,一种是重离子加速器产生的重离子12C6+射线。X射线属于低传能线密度(linear energy transfer,LET),而重离子12C6+射线属于高LET。重离子被定义为带电粒子比氦更重的离子,它们一般具有较高的相对生物效能。与低LET光子相比,重离子对受照射细胞产生了更大的遗传毒性和细胞毒性。低LET传递的吸收剂量通常经历了一个沿穿透患者身体深度的指数衰减,因此,降低了作用处癌组织的剂量[19]。高LET重离子辐射的一般特点是在它的范围内有一个能量沉积峰(即Bragg峰),它在核心的癌症组织中提供了较高的剂量区域[20]。高LET重离子辐射比低LET的X射线或γ射线对诱导生物损伤更有效[19]。本研究通过透射电镜与蛋白质免疫印迹观察,表明X射线与重离子12C6+射线均能诱导SW480细胞产生自噬,所产生的自噬水平均具有辐射剂量依赖性,但同一能量组的重离子照射所产生的自噬水平要高于X射线照射的,可能与辐射粒子的种类以及辐射的LET有关。
雷帕霉素哺乳动物靶蛋白(mTOR)是一个在PI3K/AKT通路上有吸引力的治疗靶点,它作用于功能更广泛的下游蛋白质。雷帕霉素是mTOR抑制剂,通过抑制TOR蛋白诱导了自噬[21, 22]。氯喹能够阻止溶酶体酸化和自噬体的降解(自噬途径的最后步骤)[23]。本研究中,当加入雷帕霉素之后,通过透射电子显微镜、免疫荧光显微镜观察到了自噬体形成的显著增加,Western blot法检测到了LC3Ⅱ/ LC3Ⅰ比值的增高,表明雷帕霉素能够诱导SW480细胞自噬的发生。而当加入氯喹之后,自噬水平明显降低,表明氯喹能够抑制辐射所诱导的自噬。
自噬对细胞辐射敏感性的作用尚待阐明。Paglin等[24]报道,自噬诱导保护了细胞免受辐射,而Kuwahara等[10]研究表明,自噬的活化可能增强了肿瘤的辐射敏感性。对辐射照射的自噬反应是促生存还是促进死亡,结果取决于细胞类型和细胞的状态[25]。本研究通过Transwell小室、划痕实验和MTT实验,观察到辐射使SW480细胞的迁移能力、侵袭能力和细胞活性降低,雷帕霉素与辐射诱导的自噬引起了SW480细胞的迁移能力、侵袭能力和细胞活性的显著降低,而自噬抑制剂氯喹可以抑制辐射所诱导的迁移能力、侵袭能力和细胞活性的减弱。因此,推测自噬对SW480细胞起着杀伤作用,雷帕霉素诱导自噬可以增强SW480细胞的辐射敏感性,提示SW480细胞的辐射敏感性的增加与自噬水平的增加有关。
本研究结果显示,X射线和重离子辐射均能够诱导SW480细胞发生自噬,均具有辐射剂量依赖性,且重离子辐射诱导自噬的水平高于X射线所诱导的自噬水平,这表明重离子辐射对细胞的杀伤作用要强于X射线。雷帕霉素在辐射诱导自噬的水平上能够使自噬水平显著增加,随着自噬水平的增加,SW480细胞的侵袭能力、迁移能力和细胞活性均降低,提示在结肠癌SW480细胞中,自噬发挥着杀伤细胞的作用。因此,认为提高自噬水平对增加癌细胞的辐射敏感性可能是一种有效的方法,即mTOR抑制剂雷帕霉素与辐射联合应用,能使SW480细胞通过增加自噬性细胞死亡的途径增强其辐射敏感性。由于自噬在肿瘤的发生发展中的调节机制比较复杂,且与凋亡之间存在着密切关系,自噬在肿瘤临床治疗中的具体作用还需要进一步实验研究,以期为肿瘤的治疗提供新的理论依据。
志谢 感谢重离子束辐射生物医学重点实验室开放课题及中央高校基本科研业务费专项资金(lzuibky-2015-286,lzujbky-2014-135)对本研究的支持
| [1] | He Z, Mangala LS, Theriot CA, et al. Cell killing and radiosensitizing effects of atorvastatin in PC3 prostate cancer cells[J]. J Radiat Res, 2012, 53(2): 225-233. |
| [2] | 李峰,崔德威,许卫华, 等. X射线对人鼻咽癌CNE2及CNE2/DDP细胞自噬相关基因的影响[J]. 临床耳鼻咽喉头颈外科杂志,2015, 29(6):547-551. |
| [3] | Apel A, Herr I, Schwarz H, et al. Blocked autophagy sensitizes resistant carcinoma cells to radiation therapy[J]. Cancer Res, 2008, 68(5):1485-1494. |
| [4] | Yang Z, Klionsky DJ. Mammalian autophagy: core molecular machinery and signaling regulation[J]. Curr Opin Cell Biol, 2010, 22(2): 124-131. |
| [5] | Zhao L, Teng B, Wen L,et al. mTOR inhibitor AZD8055 inhibits proliferation and induces apoptosis in laryngeal carcinoma[J]. Int J Clin Exp Med, 2014, 7(2): 337-347. |
| [6] | Zhuang W, Li B, Long L, et al. Induction of autophagy promotes differentiation of glioma-initiating cells and their radiosensitivity[J]. Int J Cancer, 2011, 129(11): 2720-2731. |
| [7] | Dai ZJ, Gao J, Kang HF, et al. Targeted inhibition of mammalian target of rapamycin (mTOR) enhances radiosensitivity in pancreatic carcinoma cells[J]. Drug Des Devel Ther, 2013, 7(3): 149-159. |
| [8] | Lozy F, Karantza V. Autophagy and cancer cell metabolism[J]. Semin Cell Dev Biol, 2012, 23(4): 395-401. |
| [9] | Chiu HW, Fang WH, Chen YL, et al. Monascuspiloin enhances the radiation sensitivity of human prostate cancer cells by stimulating endoplasmic reticulum stress and inducing autophagy[J]. PLoS One, 2012, 7(7): e40462. |
| [10] | Kuwahara Y, Oikawa T, Ochiai Y, et al. Enhancement of autophagy is a potential modality for tumors refractory to radiotherapy[J]. Cell Death Dis, 2011, 2: e177. |
| [11] | Perrotta I, Carito V, Russo E, et al. Macrophage autophagy and oxidative stress: an ultrastructural and immunoelectron microscopical study[J]. Oxid Med Cell Longev, 2011, 2011: 282739. |
| [12] | Wu YC, Wang XJ, Yu L, et al. Hydrogen sulfide lowers proliferation and induces protective autophagy in colon epithelial cells[J]. PLoS One, 2012, 7(5): e37572. |
| [13] | Lee YJ, Kim NY, Suh YA, et al. Involvement of ROS in curcumin-induced autophagic cell death[J].Korean J Physiol Pharmacol, 2011, 15(1): 1-7. |
| [14] | Chaachouay H, Fehrenbacher B, Toulany M, et al. AMPK-independent autophagy promotes radioresistance of human tumor cells under clinical relevant hypoxia in vitro[J]. Radiother Oncol, 2015, 116(3):409-416. |
| [15] | Tang Y, Li M, Wang YL, et al. ART1 promotes starvation-induced autophagy: a possible protective role in the development of colon carcinoma[J]. Am J Cancer Res, 2015,5(2): 498-513. |
| [16] | Altmeyer A, Josset E, Denis JM, et al. The mTOR inhibitor RAD001 augments radiation-induced growth inhibition in a hepatocellular carcinoma cell line by increasing autophagy[J]. Int J Oncol, 2012, 41(4): 1381-1386. |
| [17] | Ballarini F, Bortolussi S, Clerici AM, et al. From radiation-induced chromosome damage to cell death: modelling basic mechanisms and applications to boron neutron capture therapy[J]. Radiat Prot Dosim, 2011, 143(2-4): 523-527. |
| [18] | Bilak A, Uyetake L, Su TT. Dying cells protect survivors from radiation-induced cell death in Drosophila[J]. PLoS Genet, 2014, 10(3): e1004220. |
| [19] | Gong L, Jin X, Li Q, et al. Heavy ion beams induce survivin expression in human hepatoma SMMC-7721 cells more effectively than X-rays[J]. Acta Biochim Biophys Sin (Shanghai), 2007, 39(8): 575-582. |
| [20] | Castro JR, Chen GT, Blakely EA. Current considerations in heavy charged-particle radiotherapy: a clinical research trial of the University of California Lawrence Berkeley Laboratory, Northern California Oncology Group, and Radiation Therapy Oncology Group[J]. Radiat Res Suppl, 1985, 8(2): S263-271. |
| [21] | Rosenfeldt MT, Ryan KM. The multiple roles of autophagy in cancer[J]. Carcinogenesis, 2011, 32(7): 955-963. |
| [22] | Harder LM, Bunkenborg J, Andersen JS. Inducing autophagy: a comparative phosphoproteomic study of the cellular response to ammonia and rapamycin[J]. Autophagy, 2014, 10(2): 339-355. |
| [23] | Yang S, Wang X, Contino G, et al. Pancreatic cancers require autophagy for tumor growth[J]. Genes Dev, 2011, 25(7): 717-729. |
| [24] | Paglin S, Hollister T, Delohery T, et al. A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles[J]. Cancer Res, 2001, 61(2): 439-444. |
| [25] | Liang B, Kong D, Liu Y, et al. Autophagy inhibition plays the synergetic killing roles with radiation in the multi-drug resistant SKVCR ovarian cancer cells[J]. Radiat Oncol, 2012, 7: 213. |
 2015, Vol. 35
2015, Vol. 35