2. 226001 南通大学附属医院消化病研究室
放射性肺纤维化是胸部恶性肿瘤放疗后常见的并发症,严重者对肺功能和生活质量乃至生命带来极大的危害。转化生长因子β1 (transforming growth factor β1,TGF-β1)是肺纤维化疾病发生发展过程的重要因子[1, 2]。本研究通过对比检测受照前后人胚肺成纤维细胞(HFL-1)的基因谱,寻找相同基因的差异改变,并观察验证TGF-β1的差异特征,以基因沉默法干预其表达及Ⅰ、Ⅲ型胶原(collagen typeⅠ/Ⅲ,COLⅠ/Ⅲ) 产生,在细胞水平观察TGF-β1 siRNA干预纤维化的作用,为临床放射性肺纤维化的治疗提供新方法及理论依据。
1.细胞培养:HFL-1细胞系购自上海中科院细胞库(目录号GNHu28),采用F12k培养基,10%胎牛血清(FBS),100 U/ml青霉素,100 μg/ml链霉素,37℃、5% CO2饱和湿度下培养,挑选对数生长期细胞进行实验。
2.细胞分组:将HFL-1细胞分为单纯照射组和空白对照组行基因芯片实验,观察HFL-1细胞受照前后的基因差异表达;选择致纤维化基因TGF-β1,设计siRNA,将HFL-1细胞分为单纯照射组、阴性对照siRNA及TGF-β1 siRNA组,观察TGF-β1 siRNA对TGF-β1的沉默作用;将HFL-1细胞分为单纯照射组、TGF-β1 siRNA组、地塞米松组,及TGF-β1 siRNA联合地塞米松组,对比不同干预手段对HFL-1细胞受照后胶原生成的影响。
3. siRNA设计和转染:4条TGF-β1 siRNA及1条随机选取无干扰效果阴性对照序列(表1)。将上述4条TGF-β1 siRNA按照同比例混匀于同一体系中,构成siRNA pool,利用Lipofectamine2000进行转染。溶于DMSO的地塞米松溶液浓度为0.2 μmol/L。siRNA转染实验在细胞照射前24 h进行,以获得最佳的干扰效果。
| 表1 TGF-β1 siRNA和阴性对照siRNA的序列 |
4. 细胞损伤模型构建:将接种于6孔板的细胞在美国瓦里安Trilogy直线加速器下照射。6 MV X射线,照射剂量500 cGy/次,剂量率为400 cGy/min,照射野面积10 cm×10 cm,照射距离100 cm,表面覆盖1.5 cm厚聚苯乙烯。分别于照射后的24、48和72 h收集细胞及培养液上清保存于-80℃。
5.基因芯片分析:芯片实验由上海伯豪生物有限公司完成。实验RNA采用Affymetrix表达谱芯片配套试剂盒,GeneChip 3′IVT Express Kit(Cat#901229,美国Affymetrix公司)和标准操作流程,在照射24 h对空白对照组和单纯照射组细胞总RNA中的mRNA进行放大、标记和纯化,获得带有生物素(biotin)标记的cRNA后进行芯片杂交。
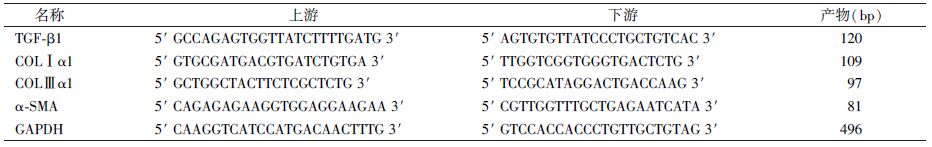
6.FQ-RT-PCR检测TGF-β1、COLⅠ、COL Ⅲ和α-SMA mRNA:引物设计根据GeneBank中查找出的目的基因及内参基因的mRNA序列,用Primer5.0软件设计,上下游引物由上海生工生物工程有限公司合成(表2)。
| 表2 荧光定量RT-PCR基因引物序列 |
7.ELISA检测TGF-β1蛋白:配制标准品,加样,孵育抗体,显色,加终止液。在30 min内用酶联仪在450 nm波长依次测量各孔的吸光度(A)值。绘制标准曲线,计算样品中蛋白的浓度。
8. 免疫组织化学检测COLⅠ和Ⅲ:细胞爬片,固定,孵育抗体,显色,封片。COLⅠ和COL Ⅲ表达主要位于细胞质,结果判定采用双盲法由两位专家进行,在光镜下进行半定量结果判断。染色强度分数标准按参考文献[3]进行。
9. Western blot检测COLⅠ和Ⅲ蛋白:细胞蛋白抽提后,按BCA法测定蛋白浓度,然后通过SDS-PAGE电泳分离,硝酸纤维膜转膜后封闭2 h,分别加入COLⅠ和Ⅲ及GAPDH抗体孵育,加入二抗孵育1 h后,化学发光法显示蛋白条带,胶片显影、定影。
10. 消化法测定羟脯氨酸(HYP):按照南京建成生物有限公司的HYP测试盒说明书进行。
11. 统计学处理:所有实验重复3次,测得数据以 ±s表示,采用Stata 7.0统计软件分析数据。样本均数两两比较,采用独立样本t检验。P<0.05为差异有统计学意义。
±s表示,采用Stata 7.0统计软件分析数据。样本均数两两比较,采用独立样本t检验。P<0.05为差异有统计学意义。
1.基因表达分析: 24 h单纯照射组HFL-1细胞中>2倍的上调基因有771个,下调基因有1 108个;>3倍的上调基因有350个,下调基因有558个;>5倍的上调基因有213个,下调基因有348个,TGF-β1上调5.154倍。这些差异表达的基因主要涉及信号转导、能量代谢、分子黏附、酶活性和转录翻译调节方面。与纤维化有关基因差异倍数为2.259~12.349,TGF/Smad基因为主要参与者。
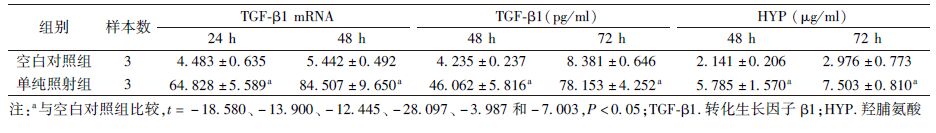
2. HFL-1细胞受照后TGF-β1和HYP的表达:检测受照后TGF-β1 mRNA表达,单纯照射组受照后24和48 h 较空白对照组明显升高(t=-18.580、-13.900,P<0.05)。ELISA法显示,照射后48和72 h的TGF-β1蛋白表达与RT-PCR结果一致(t=-12.445、-28.097,P<0.05)。HYP消化法显示,照射后48和72 h单纯照射组HYP水平较空白对照组显著升高(t=-3.987、-7.003,P<0.05,表3),提示HFL-1受照后TGF-β1及HYP均显著升高。
表3 两组细胞照射后不同时间TGF-β1 mRNA、TGF-β1和HYP的表达( ±s) ±s)
|
3. TGF-β1 siRNA转染效率:荧光显微镜下转染TGF-β1 siRNA的HFL-1细胞胞质呈绿色荧光,未转染的细胞则无,转染效率可达95%。
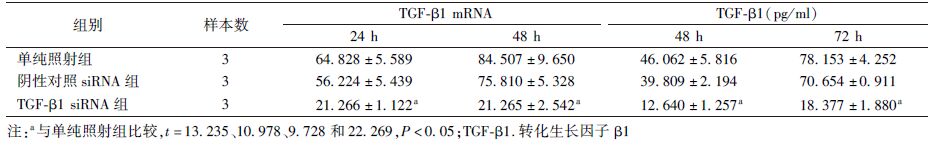
4.TGF-β1 siRNA的干预作用:TGF-β1 siRNA组TGF-β1 mRNA水平较单纯照射组,在照射后24和48 h分别下调67.196%(t=13.235,P<0.05)和74.836%(t=10.978,P<0.05)。TGF-β1蛋白在放射后48和72 h分别下调72.559%(t=9.728,P<0.05)和76.486%(t=22.269,P<0.05,表4)。
表4 3组细胞处理后不同时间TGF-β1 mRNA及TGF-β1表达( ±s) ±s)
|
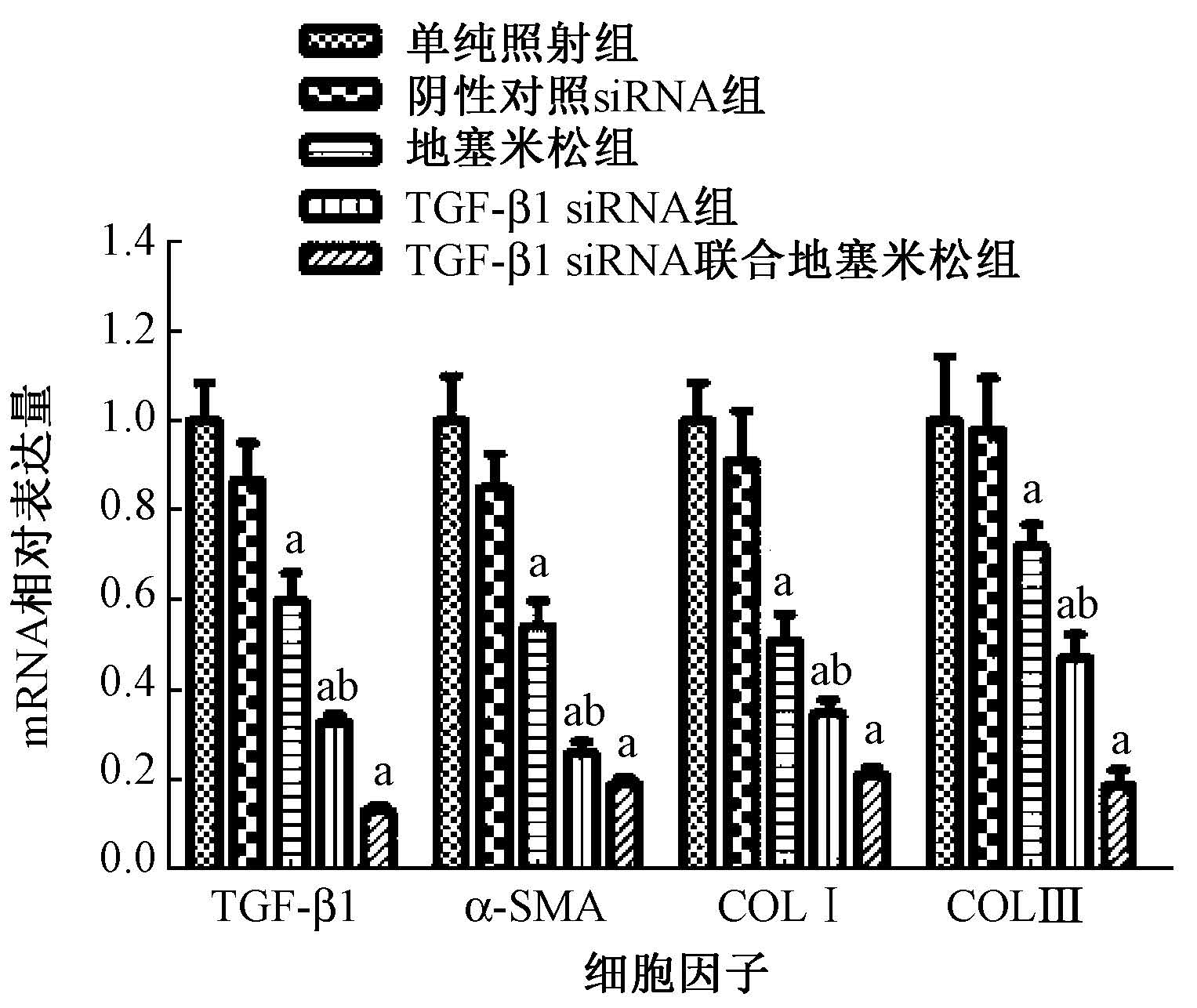
5.不同方法干预TGF-β1对胶原作用的比较:与单纯照射组比较,TGF-β1 siRNA、地塞米松、TGF-β1 siRNA联合地塞米松组均能有效降低TGF-β1(t=13.235、6.943、-17.431,P<0.05)、α-SMA(t=12.548、6.966、13.988,P<0.05)、COLⅠ(t=12.433、8.164、16.315,P<0.05)和COL Ⅲ (t=5.919、3.164、9.420,P<0.05) mRNA;且TGF-β1 siRNA作用优于地塞米松(t=7.110、7.976、4.196、5.935,P<0.05),见图1。
|
注:a与单纯照射组比较,t=-17.431~16.315,P<0.05; b与地塞米松组比较,t=7.110、7.976、4.196和5.935,P<0.05 图1 各处理组TGF-β1、α-SMA、COLⅠ、COLⅢ mRNA表达分析 |
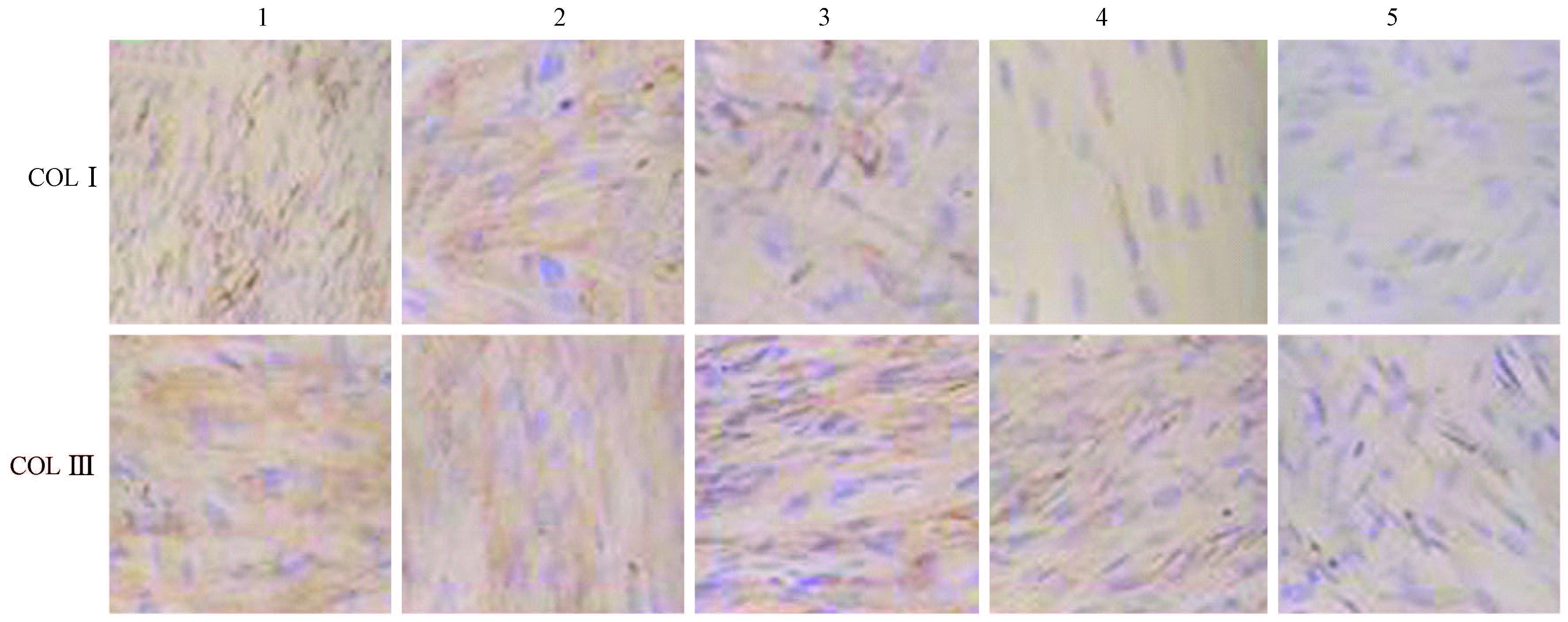
免疫组织化学染色显示,COLⅠ和Ⅲ主要表达在胞质,呈淡黄色或棕褐色,胞核呈蓝色。TGF-β1 siRNA组COLⅠ和Ⅲ较单纯照射组棕褐色范围小、着色程度浅,差异有统计学意义(t=4.242、3.536,P<0.05,图2),且上述3种方法干预胶原产生的强弱趋势与基因结果一致。Western blot结果亦如此(图3)。
|
注:1.单纯照射组;2.阴性对照siRNA组;3.地塞米松组;4.TGF-β1组;5.TGF-β1联合地塞米松组 图2 各处理组COLⅠ和Ⅲ蛋白表达镜下观察 免疫组织化学染色 ×200 |

|
注:1.单纯照射组;2.阴性对照siRNA组;3.地塞米松组; 4.TGF-β1组;5.TGF-β1联合地塞米松组 图3 各处理组COLⅠ和Ⅲ蛋白表达分析 |
放射性肺损伤、肺纤维化限制放射治疗的剂量,阻碍肿瘤的控制,影响患者的生活质量,甚至导致肺功能不全及死亡[4]。放射性肺纤维化的防治,糖皮质激素已被广泛使用,多年来被认为是标准治疗方法,但有很多不良反应,如高血压、高血糖、骨质疏松、免疫抑制致肿瘤复发[5]。新的药物,如吡非尼酮和细胞抗氧化剂已在动物实验和临床试验中研究应用,然而其疗效不确切,也缺乏大量随机对照临床试验的依据[6, 7, 8]。因此,迄今为止,放射性肺纤维化尚缺乏有效的治疗手段,亟待寻找新的安全有效方法。
在一系列的生长因子和细胞因子中,TGF-β1是各种生物过程中的多效性细胞因子。已有研究表明,TGF-β1与纤维化疾病的发生发展密切相关[9, 10]。本研究首先通过基因芯片技术分析HFL-1细胞受照后的相同基因差异表达。结果显示,HFL-1细胞受照后差异基因总数为1 879个,上调基因为771个,下调基因为1 108个,其中上调5倍以上的基因213个,这些差异表达的基因主要涉及信号转导、能量代谢、分子黏附、酶活性和转录翻译调节方面功能。与纤维化有关基因差异倍数为2.259~12.349,TGF-β1上调5倍多,TGF/Smad基因是纤维化的主要参与者。
根据前期的研究[11]及本实验基因谱结果,选择TGF-β1基因作为纤维化发生的关键基因。以RT-PCR和ELISA法检测了受照后TGF-β1的表达。发现500 cGy 6 MV X射线单次照射细胞,明显上调TGF-β1表达,符合基因芯片结果。研究中选取HYP、COLⅠ和Ⅲ作为TGF-β1 下游产物纤维化指标反映纤维化程度,发现照射组细胞HYP水平显著升高,与TGF-β1的表达平行,提示TGF-β1的上调导致纤维化产物增加,与其他研究者报道一致[8]。因此,鉴于TGF-β1是放射性肺纤维化发展过程的关键因子,干预TGF-β1上调应当成为阻止纤维化产物的治疗靶点。
RNAi,又称转录后基因沉默,指将特异性同源小双链RNA (dsRNA)分子导入细胞,降解与其序列互补配对的mRNA,诱导特异的目标基因沉默[12]。RNAi广泛用于治疗病毒性感染、肿瘤、免疫缺陷病和遗传疾病,特别是癌症、艾滋病和肝脏疾病[12]。本研究中,TGF-β1 siRNA由4个外源合成的双链siRNA制备的siRNA pool构成,转染细胞后首先观察转染效率,发现siRNA转染效率可高达95%。RT-PCR和ELISA结果表明TGF-β1 siRNA明显下调TGF-β1的表达,说明RNAi可有效地沉默TGF-β1基因。实验进一步发现,TGF-β1表达抑制后,α-SMA、COLⅠ和Ⅲ的合成明显减少。
地塞米松是一种肾上腺皮质激素,为临床常用的抗放射损伤药物,主要通过非特异抗炎和抗过敏作用,抑制炎症介质和细胞因子产生,从而阻断TGF-β1和纤维化物质的产生。有文献表明,地塞米松可有效地改善肺功能[5]。其抗炎作用确切,但不良反应大。本研究对比观察地塞米松和TGF-β1 siRNA的抗胶原作用,结果表明,TGF-β1 siRNA作用优于地塞米松,且两者联合应用具有协同作用。
综上所述,本研究首次采用基因芯片技术,分析HFL-1细胞受照前后相同基因差异表达,其中TGF-β1明显上调,而TGF-β1 siRNA可成功干扰其合成,下调纤维化产物胶原的产生,且作用优于地塞米松,推测是因其能沉默与之序列互补配对的目标基因,特异性高所致。
本研究中,TGF-β1 siRNA仅在体外得到可喜的结果,有待进一步进行体内实验。基因芯片结果中上调更高倍数的基因亦有待进一步探讨。
| [1] | Mirzamani MS, Nourani MR, Imani Fooladi AA, et al. Increased expression of transforming growth factor-β and receptors in primary human airway fibroblasts from chemical inhalation patients[J]. Iran J Allergy Asthma Immunol,2013,12(2): 144-152. |
| [2] | Ding NH, Li JJ, Sun LQ. Molecular mechanisms and treatment of radiation-induced lung fibrosis[J]. Curr Drug Targets,2013,14(11): 1347-1356. |
| [3] | Xiao MB, Jiang F, Ni WK, et al. High expression of S100A11 in pancreatic adenocarcinoma is an unfavorable prognostic marker[J]. Med Oncol,2012, 29(3): 1886-1891. |
| [4] | Marks LB, Bentzen SM, Deasy JO, et al. Radiation dose-volume effect in the lung[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3 Suppl): S70-76. |
| [5] | Collard HR, King TE. Treatment of idiopathic pulmonary fibrosis: the rise and fall of corticosteroids[J]. Am J Med,2001, 110(4): 326-328. |
| [6] | Nakazato H, Oku H, Yamane S, et al. A novel anti-fibrotic agent pirfenidone suppresses tumor necrosis factor-alpha at the translational level[J]. Eur J Pharmacol,2002, 446(1-3): 177-185. |
| [7] | Card JW, Racz WJ, Brien JF, et al. Differential effect of pirfenidone on acute pulmonary injury and ensuing fibrosis in the hamster model of amiodarone-induced pulmonary toxicity[J]. Toxicol Sci, 2003, 75(1): 169-180. |
| [8] | Hisatomi K, Mukae H, Sakamoto N, et al. Pirfenidone inhibits TGF-beta1-induced over-expression of collagen type I and heat shock protein 47 in A549 cells[J]. BMC Pulm Med,2012, 12: 24. |
| [9] | Annes JP, Munger JS, Rifkin DB. Making sense of latent TGF beta activation[J]. J Cell Sci,2003, 116(Pt 2): 217-224. |
| [10] | Martin M, Lefaix J, Delanian S. TGF-β1 and radiation fibrosis: a master switch and a specific therapeutic target?[J]. Int J Radiat Oncol Biol Phys,2000, 47(2): 277-290. |
| [11] | 陈不尤,李曙光,肖明兵,等.放射性肺炎方抗大鼠放射性肺纤维化作用机制的研究[J].中华放射医学与防护杂志,2012,32(5):475-480. |
| [12] | Lang Q, Liu Q, Xu N, et al. The antifibrotic effects of TGF-beta1 siRNA on hepatic fibrosis in rats[J]. Biochem Biophys Res Commun,2011,409(3): 448-453. |
 2015, Vol. 35
2015, Vol. 35