2. 10006 南京医科大学附属南京医院 南京市第一医院 神经外科
脑胶质瘤(glioblastoma multiforme,GBM)是脑内恶性肿瘤中常见,且发病率、病死率最高的肿瘤[1],中位生存期短,肿瘤细胞浸润所致局部复发是其预后差的主要原因。目前,常规影像学手段尚难以精确界定手术和放疗范围。整合素αⅤβ3在胶质瘤细胞表面及周围新生血管内皮细胞表面高水平表达,而在成熟的血管和正常组织细胞中的水平极低[2],成为近年来脑胶质瘤靶向显像重要的药物靶点。精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)多肽及含RGD多肽序列的配体可与整合素αⅤβ3特异性结合,是具有前景的靶点。本研究制备整合素αⅤβ3靶向的99Tcm-半乳糖化精氨酸-甘氨酸-天冬氨酸多肽(99Tcm-HYNIC-Galacto-RGD2-tricine-TPPTS,99Tcm-Galacto-RGD2),并考察其用于脑胶质瘤原位病灶的microSPECT/CT靶向显像的价值。
1.实验动物:昆明小鼠40只,6周龄,体重(18±2)g;BALB/c nunu裸鼠雄性18只,4~5周龄,体重(16±2)g,均购自上海斯莱克实验动物有限公司。许可证号:SCXK(沪)2012-0002。 分别置于一般环境和SPF层流架饲养。
2. 主要试剂及仪器:Hynic-Galacto-RGD2试剂盒由美国普渡大学刘爽教授惠赠;放射性高锝酸钠溶液由南京森科公司提供;人脑恶性胶质母细胞瘤U87MG细胞系由本院中心实验室保存;胎牛血清(FBS)及小牛血清(FCS)购置于美国GIBCO公司;细胞培养基由南京凯基生物公司提供;羊血清、啮齿动物抗整合素β3抗体、大鼠抗CD31抗体、Cy3标记羊抗啮齿动物二抗和荧光素(FITC)标记羊抗大鼠二抗均购自美国BD Biosciences公司。γ放射免疫计数仪(GC-1200)购自合肥中科中佳科学仪器有限公司;小动物单光子发射计算机断层显像(microSPECT-CT)(U-SPECT/CT II)购于荷兰Milabs公司;高效液相色谱(HPLC)(LC-20AT)仪购于日本岛津公司。
3. 99Tcm-Galacto-RGD2的制备及理化性质:一步法制备99Tcm-Galacto-RGD2。取Hynic-Galacto-RGD2冻干试剂盒(20 μg HYNIC-Galacto-RGD2,7 mg TPPTS,6.5 mg两性离子缓冲剂,40 mg甘露醇,38.5 mg琥珀酸钠六水合物),室温放置10 min,加入1~1.5 ml(740 MBq/ml)放射性高锝酸钠溶液(Na99TcmO4),100℃沸浴反应30 min,获得的标记物通过放射性HPLC测定放射化学纯度,参数为:流动相A为25 mmol/L醋酸铵缓冲液(NH4OAc,0.025 mol/L,pH=5.0)(含0.1%三氟醋酸),流动相B为乙腈(含0.1%三氟醋酸),流速1.0 ml/min;二元高压梯度:参考文献[3]。20 μl标记物上样,另取0.5 ml加入到10%FBS,37℃恒温箱中温育0.5、1 和2 h分别测定标记率,考察其体外稳定性。
4. 99Tcm-Galacto-RGD2细胞特异性实验:人脑胶质瘤细胞培养基为含10%FCS最低基础培养基(EMEM),置于37℃,5%CO2培养箱培养,传代,收集并调整细胞浓度为5×104/ml,加入96孔板,每孔加200 μl,同时分别加入5×105计数/min的125I-echistatin(3.7×1013 Bq/mmol)和浓度递增的(0~1 000 nmol/L)未经核素标记的Hynic-Galacto-RGD2,培养箱内共培养(37℃,5%CO2)2 h,弃游离未结合的125I-echistatin,200 μl培养基冲洗3次,收集细胞,通过γ放射免疫计数仪测定125I放射性计数,通过非线性回归分析计算Hynic-Galacto-RGD2与脑胶质瘤细胞的IC50。
5. 99Tcm-Galacto-RGD2的生物分布:昆明小鼠用随机数字表法分成4组,分别在尾静脉注射99Tcm-Galacto-RGD2(37 MBq/ml)后10、30、60和120 min,心脏穿刺取血(1~2 ml),颈椎脱臼处死,取心、肝、脾、肺、肾脏、胃、肠道和脑等重要脏器称湿重,通过放射免疫计数仪进行放射性计数,获得不同脏器放射性摄取。其中,放射性摄取(%ID/g)=脏器的放射性计数/脏器重量/注射药物的放射性计数。同时,在每组鼠处死时取大小便,通过乙腈提纯,以离心半径20 cm,4 000 r/min,离心10 min后,取上清液进行HPLC分析,考察99Tcm-Galacto-RGD2体内稳定性。
6. 原位脑胶质瘤动物模型的建立:收集脑胶质瘤细胞(U87MG),调整细胞浓度为1×107/ml,备用。取雄性BALB/c小鼠,腹腔注射0.5%戊巴比妥钠麻醉,根据参考文献[4, 5, 6],采用立体定位植入U87MG细胞进入左纹状体,定位坐标为:前囟前方0.6 mm,离正中线左侧1.7 mm,向颅骨腹侧面3.5 mm,细胞悬液输注速率为1 μl/min。待肿瘤模型构建后6周或荷瘤鼠出现明显活动异常、体重降低明显时行microSPECT/CT显像。
7.microSPECT/CT显像:3只荷脑胶质瘤(U87MG)原位病灶裸鼠尾静脉注射3.7 MBq 99Tcm-Galacto-RGD2后30、60和120 min分别进行microSPECT-CT显像,microSPECT扫描参数为:20 min,75次投射;CT扫描电压45 kV,电流500 μA,图像重建通过POSEM程序完成,microCT图像重建通过滤波反投影算法完成,将microSPECT数据根据体素与microCT数据完全匹配,得到新的microSPECT数据,进行microSPECT/CT图像融合,调整获得较好的对比度和低噪音图像。参考文献[7]方法,在microSPECT/CT融合图像上,逐层勾画肿瘤边界获得肿瘤感兴趣区,通过PMOD软件(瑞士PMOD Technologies公司)计算肿瘤体积及肿瘤病变放射性摄取计数,计算肿瘤放射性摄取(%ID和%ID/g),以对侧正常脑组织为本底,显像结束处死小鼠,解剖分离肿瘤及周围脑组织进行重量测定和病理学检查。根据解剖分离获得肿瘤重量和密度(1.05 g/ml)计算肿瘤参考体积,基于microSPECT-CT融合显像勾画肿瘤感兴趣区获得的肿瘤体积与肿瘤参考体积进行一致性分析。取另外3只荷瘤鼠在尾静脉注射3.7 MBq 99Tcm-Galacto-RGD2以前2 min,静脉注射50倍剂量未经核素标记的Hynic-Galacto-RGD2。以上实验重复2次。
8.病理学检查:冰冻切片封闭30 min,加啮齿动物抗整合素β3抗体(1∶100)和大鼠抗CD31抗体(1∶100),室温避光反应3 h,磷酸缓冲液冲洗后加二抗(Cy3标记羊抗-hamster二抗和荧光素标记羊抗大鼠),常温条件下遮光3 h,磷酸缓冲液洗涤后甘油封片,采用放大倍数均为100倍,利用ImageJ处理荧光显微镜照片定量组织CD31和整合素β3表达水平,荧光密度表达为荧光面积占视野整个面积的百分比。同时进行HE染色,显微镜下观察组织结构。
9. 统计学处理:统计分析均采用GraphPad Prism 5.0软件,计量资料以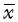 ±s表示。两组均数比较采用t检验,生物分布数据采用方差分析并进行LSD-t两两比较,P<0.05为差异有统计学意义。Bland-Altman一致性检验分析肿瘤感兴趣区获得的肿瘤体积与肿瘤参考体积一致性;对肿瘤组织放射性摄取与肿瘤组织整合素受体表达水平进行相关性分析。
±s表示。两组均数比较采用t检验,生物分布数据采用方差分析并进行LSD-t两两比较,P<0.05为差异有统计学意义。Bland-Altman一致性检验分析肿瘤感兴趣区获得的肿瘤体积与肿瘤参考体积一致性;对肿瘤组织放射性摄取与肿瘤组织整合素受体表达水平进行相关性分析。
1. 99Tcm-Galacto-RGD2的放射化学纯度及体外理化性能:99Tcm-Galacto-RGD2放射性比活度为740 MBq/ml。99Tcm-Galacto-RGD2出峰时间为13.5 min,放射化学纯度为(97.7±0.8)%,体外放置0.5、1、2 h放射化学纯度均高于95%,99Tcm-Galacto-RGD2与U87MG细胞特异性结合,Hynic-Galacto-RGD2与U87MG细胞整合素αⅤβ3受体亲合实验IC50为(18±3)nmol/L。
2.99Tcm-Galacto-RGD2在正常昆明小鼠体内生物学分布:结果见表1。99Tcm-Galacto-RGD2从血液清除迅速,10 min血液放射性摄取高于60 min组(t=11.00,P=0.01)。肝、脾摄取略高,但排泄快,药物主要通过肾脏排泄,肾脏60 min放射性摄取显著低于10 min(t=9.33,P=0.027)。脑组织放射性摄取低,与血液接近,心、肺、胃、肠等脏器摄取较少,99Tcm-Galacto-RGD2体内稳定性好,尾静脉注射2 h小便和大便中提取获得的放射性标记物放射性化学纯度分布为(94.3±4.11)%和(94.47±3.62)%。
表1 99Tcm-Galacto-RGD2注射后不同时间在正常昆明小鼠体内生物学分布 (%ID/g,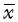 ±s) ±s)
|
|
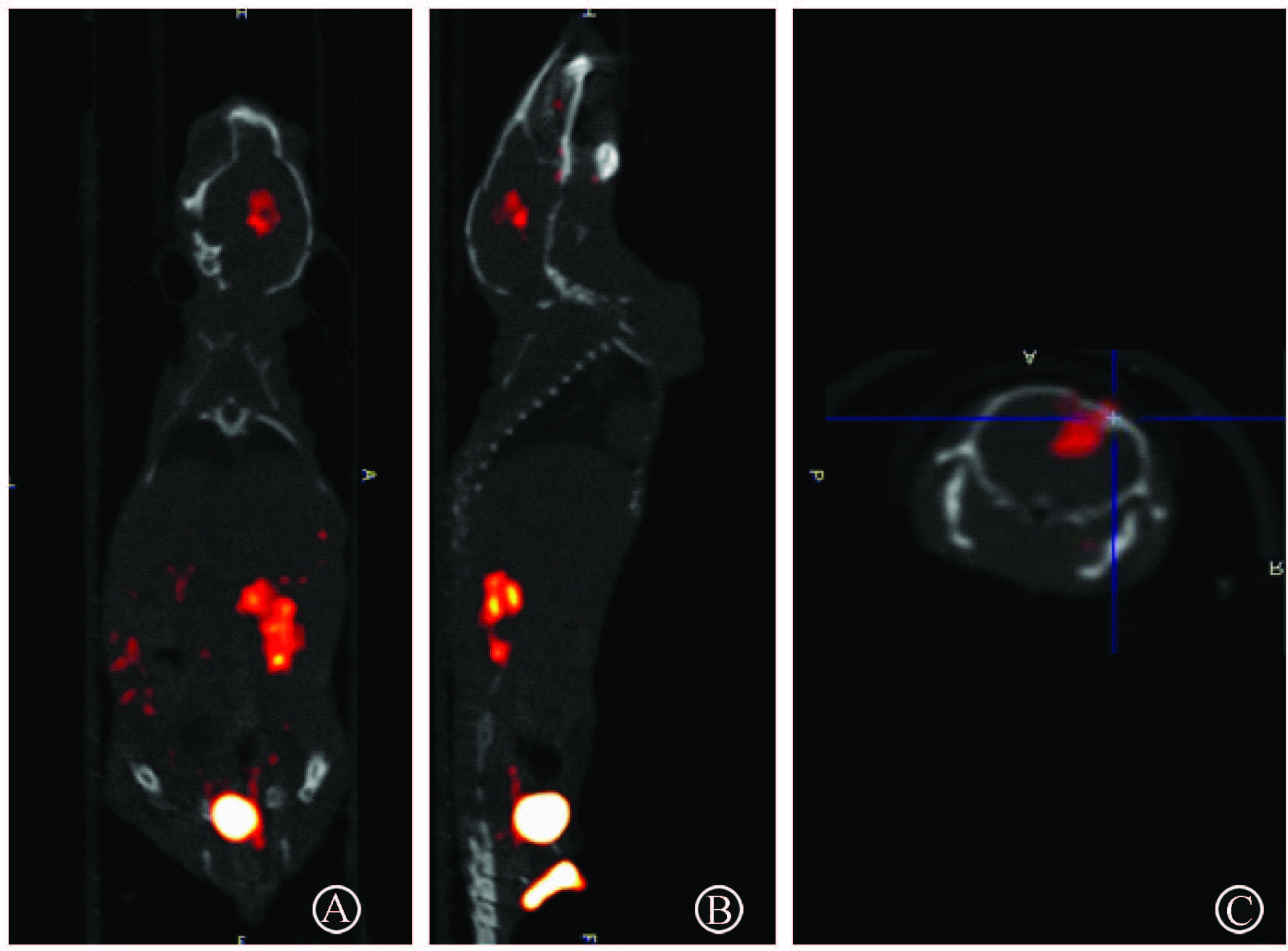
图1 荷人脑胶质瘤原位病灶裸鼠模型99Tcm-Galacto-RGD2 microSPECT-CT融合图像 A. 冠状位;B. 矢状位;C.横断位 |
3. 99Tcm-Galacto-RGD2在原位脑胶质瘤荷瘤鼠microSPECT/CT显像:尾静脉注射99Tcm-Galacto-RGD2后0.5、1和2 h,microSPECT/CT显像结果显示,脑部原位肿瘤部位可见明显放射性浓聚(图1),中心区可见少量放射性稀疏区,考虑与肿瘤中心坏死有关,而周围正常脑组织基本未见放射性摄取显影,两者边界清晰。1 h时肿瘤与正常脑组织放射性摄取比为9.2±2.1,1 h肿瘤放射性摄取为(9.15±2.24) %ID/cm3,明显高于30 min时的(7.01±1.14) %ID/cm3(t=7.13,P=0.007),而与2 h时(9.82±3.11) %ID/cm3差异无统计学意义。竞争抑制实验显示,预先注射Galacto-RGD2,2 min后尾静脉注射99Tcm-Galacto-RGD2,此后1 h,肿瘤放射性摄取为(1.82±0.41)%ID/cm3,显著低于非竞争阻断组(9.15±2.24)%ID/cm3(t=11.364,P=0.001);肿瘤/脑组织放射性摄取比为13.92±3.43。基于microSPECT-CT融合显像勾画肿瘤感兴趣区获得的肿瘤体积与肿瘤参考体积进行Bland-Altman一致性检验分析,两者具有较好的一致性(95%CI=-11.94%~11.92%),见图2。

|
注:横坐标为影像及解剖获得肿瘤体积的均值,纵坐标为解剖获得肿瘤体积与影像获得肿瘤体积的差值占上述均值的百分比 图2 基于microSPECT/CT勾画感兴趣区得到的肿瘤体积与肿瘤参考体积进行Bland-Altman绘图一致性分析 |
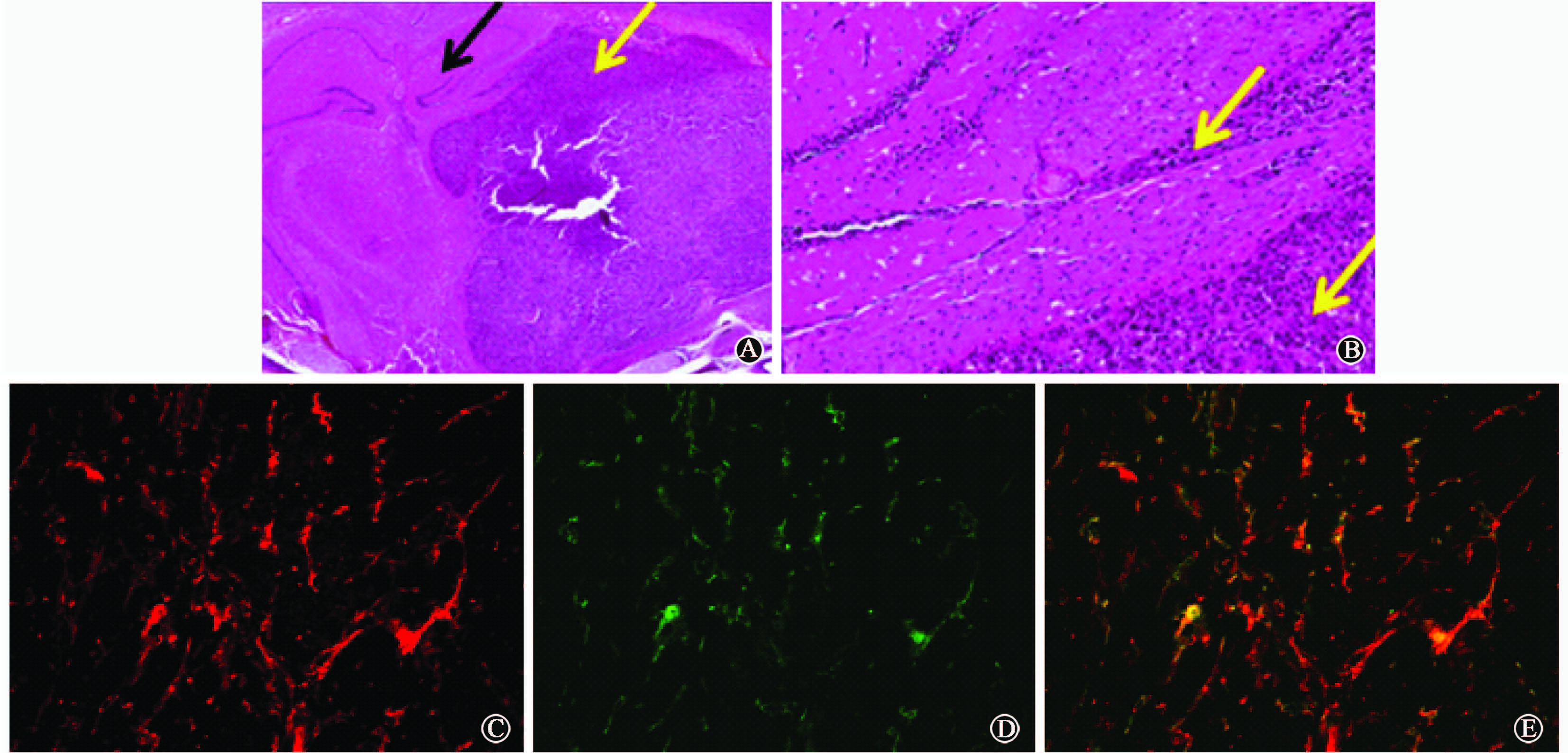
|
注:黑色箭头为脑组织,黄色箭头为脑胶质瘤组织及向周围脑组织的浸润 图3 脑胶质瘤及整合素αⅤβ3 的表达镜下观察 A. 脑胶质瘤病理观察 HE染色 ×2; B. 脑胶质瘤病理观察 HE染色 ×10; C. 整合素αⅤβ3的分布和表达(包括肿瘤细胞和新生血管内皮细胞) 免疫荧光染色 ×100; D. 血管CD31分布和表达(包括成熟血管和新生血管) 免疫荧光染色 ×100; E.融合图像,黄色表示新生血管上整合素αⅤβ3 的表达 免疫荧光染色 ×100 |
4. 病理学检查: 见图3。 HE染色可见脑胶质瘤组织位于脑组织内部,肿瘤中心区见少量坏死区,肿瘤边缘伴有向周围脑组织不同程度的浸润,同microSPECT-CT显像具有较好的一致性。以肿瘤整合素αⅤβ3表达水平(红色荧光面积与总面积的比值)为纵坐标,基于microSPECT-CT融合图像勾画感兴趣区测得的脑胶质瘤肿瘤放射性摄取为横坐标进行相关性分析,见图4。

|
图4 肿瘤放射性摄取与整合素αⅤβ3表达水平的相关性 |
多形性恶性胶质瘤是恶性程度最高的脑原发性恶性肿瘤,其有效诊断和病灶范围的精确确定仅依靠一般影像学手段较为困难。18F-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)是临床肿瘤显像主要放射性药物[8],但正常脑组织葡萄糖代谢活跃,FDG摄取高,在低级别脑胶质瘤FDG摄取较低,因此,18F-FDG用于脑胶质瘤的显像和精确识别肿瘤区域难度较大[9],且特异性较低[5]。
GBM由具有较高增殖能力的脑胶质瘤细胞和新生血管内皮细胞构成[10],而整合素αⅤβ3因在上述组织高表达[11],而在脑正常组织低表达,是近年来脑胶质瘤靶向显像的热点,但以皮下移植瘤动物模型为主[3]。本研究以原位肿瘤模型为基础,能够更好地还原肿瘤的病理生理学[12],脑胶质瘤主要向周围脑组织浸润性生长,瘤体与周围组织界限的勾画直接影响治疗野,勾画过小可引起肿瘤手术和放射治疗野遗漏并导致脑胶质瘤复发,勾画过大则引起正常脑组织不必要的损伤和功能缺陷。
放射性核素标记的环状RGD多肽可以用于脑胶质瘤所表达的整合素αⅤβ3受体靶向显像,18F-Galacto-RGD第一个被应用于临床试验[13, 14, 15],且肿瘤对18F-Galacto-RGD 与肿瘤整合素αⅤβ3表达水平密切相关[13, 14]。由于18F-Galacto-RGD的制备无相应常规制备模块且辐射剂量大,防护要求高,而使相应试验终止,其临床应用也因PET仪器配备及检查费用昂贵而受限。为解决以上问题,本研究利用一步法合成99Tcm-Hynic-Galacto-RGD2,制备过程简单,放射化学纯度高,体内外稳定性好,2 h大小便中其放射化学纯度分别为(94.3±4.11)%和(94.47±3.62)%,明显高于目前进入临床试验研究的99Tcm-3P-RGD2[16],且细胞实验结果显示,Hynic-Galacto-RGD2与脑胶质瘤细胞整合素αⅤβ3受体亲和实验IC50为(18±3)nmol/L,低于99Tcm-3P-RGD2[16],生物学分布结果显示,99Tcm-Hynic-Galacto-RGD2肝肾排泄较99Tcm-3P-RGD2快。文献报道,放射性核素标记多肽的体内特性,除受多肽为线型肽、环状肽或者为单体、多聚体的结构影响外,核素与RGD多肽间的耦联基团对核素标记多肽的体内生物学分布也具有重要的决定作用[16]。99Tcm-Hynic-Galacto-RGD2以上理化性质考虑与Galacto耦联剂的亲水性能有关,在RGD多肽类显像剂中更有优势和临床转化的前景,并为应用177Lu及90Y等治疗性核素标记的Galacto-RGD2的研发和脑胶质瘤内放射靶向治疗提供新的数据支持。
99Tcm-Galacto-RGD2的 microSPECT-CT融合显像结果显示,脑胶质瘤与周围正常组织分界明显,利于脑胶质瘤病灶的感兴趣区勾画,基于显像获得的肿瘤体积与肿瘤实际体积具有较好的一致性,为解决脑胶质瘤原位病灶的边界勾画提供较好的手段。同时,99Tcm-Galacto-RGD2 microSPECT-CT显像除了有效定量脑胶质瘤体积外,microSPECT-CT可对99Tcm标记药物的放射性活度进行精确定量,为microSPECT-CT显像定量评价肿瘤部位放射性分布奠定基础。本研究结果显示,脑胶质瘤病灶对99Tcm-Galacto-RGD2的放射性摄取与肿瘤整合素αⅤβ3表达水平呈线性相关,与文献报道18F-RGD2 PET显像可定量肿瘤放射性摄取并有效反映肿瘤整合素αⅤβ3表达水平[17]相似。
综上,99Tcm-Galacto-RGD2 microSPECT-CT显像可有效评估肿瘤整合素αⅤβ3表达水平,也为治疗性核素标记RGD多肽靶向治疗脑胶质瘤提供数据支持。
| [1] | Schneider T, Mawrin C, Scherlach C, et al. Gliomas in adults[J]. Dtsch Arztebl Int, 2010,107(45):799-807, 808. |
| [2] | Liu Y, Yang Y, Zhang C. A concise review of magnetic resonance molecular imaging of tumor angiogenesis by targeting integrin αvβ3 with magnetic probes[J]. Int J Nanomedicine, 2013,8:1083-1093. |
| [3] | Shao G, Zhou Y, Wang F, et al. Monitoring glioma growth and tumor necrosis with the U-SPECT-II/CT scanner by targeting integrin αvβ3[J]. Mol Imaging, 2013,12(1):39-48. |
| [4] | Arcella A, Biagioni F, Antonietta Oliva M, et al. Rapamycin inhibits the growth of glioblastoma[J]. Brain Res, 2013,1495:37-51. |
| [5] | Sai KK, Huang C, Yuan L, et al. 18F-AFETP, 18F-FET, and 18F-FDG imaging of mouse DBT gliomas[J]. J Nucl Med, 2013,54(7):1120-1126. |
| [6] | Park SS, Chunta JL, Robertson JM, et al. MicroPET/CT imaging of an orthotopic model of human glioblastoma multiforme and evaluation of pulsed low-dose irradiation[J]. Int J Radiat Oncol Biol Phys, 2011,80(3):885-892. |
| [7] | Carlson SK, Classic KL, Hadac EM, et al. In vivo quantitation of intratumoral radioisotope uptake using micro-single photon emission computed tomography/computed tomography[J]. Mol Imaging Biol, 2006,8(6):324-332. |
| [8] | Colavolpe C, Metellus P, Mancini J, et al. Independent prognostic value of pre-treatment 18-FDG-PET in high-grade gliomas[J]. J Neurooncol, 2012,107(3):527-535. |
| [9] | Miyake K, Shinomiya A, Okada M, et al. Usefulness of FDG, MET and FLT-PET studies for the management of human gliomas[J]. J Biomed Biotechnol, 2012,2012:205818. |
| [10] | 郑媛媛, 王继红, 李庆伟. 以整合素αⅤβ3为靶点的RGD配体在抗肿瘤血管新生中的应用[J]. 中国生物化学与分子生物学报, 2013,29(4):299-305. |
| [11] | 梁宇佳, 熊玮. 整合素介导uPAR信号转导途径的研究进展[J]. 中华肿瘤防治杂志, 2011,18(12):970-974. |
| [12] | 黄宽明, 涂汉军, 李新建, 等. 大鼠皮层C6脑胶质瘤模型的建立[J]. 中华肿瘤防治杂志, 2003,10(5):490-492. |
| [13] | Haubner R, Weber WA, Beer AJ, et al. Noninvasive visualization of the activated αⅤβ3 integrin in cancer patients by positron emission tomography and [18F]Galacto-RGD[J]. PLoS Med, 2005,2(3):e70. |
| [14] | Beer AJ, Kessler H, Wester HJ, et al. PET imaging of integrin αⅤβ3 expression[J]. Theranostics, 2011,1:48-57. |
| [15] | Liu S, Liu Z, Chen K, et al. 18F-labeled galacto and PEGylated RGD dimers for PET imaging of αⅤβ3 integrin expression[J]. Mol Imaging Biol, 2010,12(5):530-538. |
| [16] | Wang L, Shi J, Kim YS, et al. Improving tumor-targeting capability and pharmacokinetics of (99m)Tc-labeled cyclic RGD dimers with PEG(4) linkers[J]. Mol Pharm, 2009,6(1):231-245. |
| [17] | Mirfeizi L, Walsh J, Kolb H, et al. Synthesis of [18F]RGD-K5 by catalyzed [3+2] cycloaddition for imaging integrin αⅤβ3 expression in vivo[J]. Nucl Med Biol, 2013,40(5):710-716. |
 2015, Vol. 35
2015, Vol. 35