立体定向放射治疗对不能耐受或拒绝手术的早期非小细胞肺癌患者是根治性的治疗手段[1, 2, 3]。射波刀拥有的肺追踪系统对周围型肺癌的立体定向放射治疗实现了无需植入金标的实时呼吸追踪[4]。其计划系统中的机器跳数优化参数(OMU)可以最大幅度减小计划中的机器跳数(MU)总数。研究表明,肺低剂量区体积V5为胸部放疗患者发生2级以上放射性肺炎(RP)的重要预测因素[5]。本研究旨在探讨了OMU优化参数在周围型肺癌的射波刀计划设计中对正常肺组织受量的影响。
1.临床资料:回顾性分析2014年10月至2015年2月在上海长海医院接受射波刀治疗的10例肺癌患者。入组标准为具有病理活检确诊为非小细胞肺癌,年龄18~85岁,病灶数目1个,病灶最大径≤3 cm,预计生存期>6个月,美国东部肿瘤协作组(ECOG)评分≤2;排除有放疗史,有远处转移的患者。病例类型为孤立病灶周围型肺癌,患者年龄62~81岁,中位年龄65岁。
2.定位方法:采用真空垫固定患者,仰卧位,双手自然放置于身体两侧,使用荷兰飞利浦公司Brilliance Big Bore 16排大孔径CT模拟定位机进行患者吸气末屏气扫描定位。扫描条件为120 kVp、400 mAs、1.5 mm层厚无间隔螺旋扫描,扫描螺距为0.938,扫描范围为肿瘤上下界各自增加15 cm,包括全肺。
3.靶区和危及器官勾画:CT图像传至射波刀数据管理系统(CDMS),由临床医生参照国际辐射单位和测量委员会(ICRU)[JP]83号报告定义进行肿瘤区(GTV)和危及器官(OAR)的勾画[6]。勾画完成后对GTV外放5 mm为计划靶区(PTV)。
4.治疗计划设计:治疗计划系统采用美国Accuray公司的MultiPlan®计划系统,版本号4.0.2。10例患者全部采用XsightTM Lung追踪模式,由物理师勾画出肿瘤追踪区域以及脊柱追踪区域,进行计划优化。
对每例患者分别给予PTV处方剂量60 Gy/5次,分OMU优化计划和无OMU优化计划。无OMU优化计划仅针对PTV利用覆盖率优化参数(OCO)进行一步优化,OMU优化计划则在PTV优化基础上增加OMU优化参数,为两步优化。为保证计划对比的一致性,要求两种优化计划最终的节点数、射野数相同,优化完成后均采用高密度计算网格进行最终的剂量计算。计划评估要求处方剂量包绕95% PTV体积的标准,即覆盖率≥95%进行归一。计划评估参数包括PTV所接受的最大剂量Dmax、最小剂量Dmin和平均剂量Dmean以及PTV的适形指数(CI)、新适形指数(nCI)和均匀指数(HI)。CI=PIV/TIV。式中,PIV为处方剂量所包绕的体积,mm3;TIV为处方剂量所包绕的靶区体积,mm3。nCI=CI/覆盖率。式中,覆盖率为靶区接受的超过处方剂量的体积占靶区总体积的百分比,%。HI=Dmax/RxDose。式中,RxDose为处方剂量,cGy。危及器官受量评估参数包括患侧肺平均剂量及全肺的V5、脊髓、心脏、食管、气管、小支气管的体积限量,其中脊髓观察0.35 cm3体积剂量,心脏观察15 cm3体积剂量,食管观察限量5 cm3体积剂量,气管观察限量4 cm3体积剂量,小支气管观察限量0.5 cm3体积剂量,标准均参照美国医学物理学家协会(AAPM)101号报告给出的限定值[8]。同时评估计划的MU、计划优化时间以及计划治疗时间。
5.统计学处理:数据以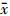 ± s表示。采用SPSS 19统计软件进行数据处理,对两种计划的参数比较采用配对t检验。P < 0.05为差异有统计学意义。
± s表示。采用SPSS 19统计软件进行数据处理,对两种计划的参数比较采用配对t检验。P < 0.05为差异有统计学意义。
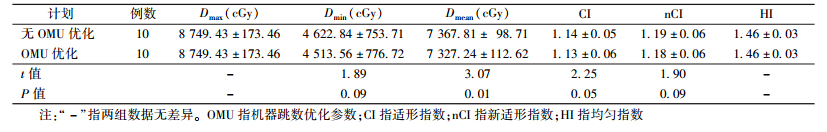
1.PTV剂量分布:肺癌患者有无OMU优化的PTV剂量比较结果列于表1。由表1可知,与无OMU优化计划比较,使用OMU优化计划时,PTV的平均剂量Dmean有所降低,差异有统计学意义(t=3.07,P < 0.05);PTV的最小剂量Dmin以及CI、nCI均略有降低,但差异无统计学意义(P>0.05);PTV所接受的最大剂量Dmax以及HI数值无变化。
表 1 肺癌患者有无OMU优化的计划靶区剂量比较 (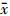 ± s) ± s)
|
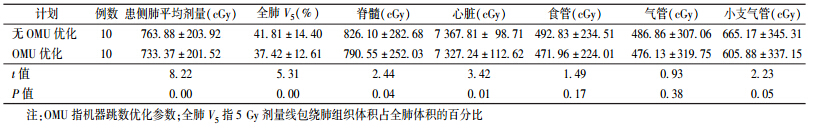
2.危及器官受量:肺癌患者有无OMU优化的危及器官剂量比较结果列于表2。由表2可知,与无OMU优化计划相比,使用OMU优化计划时,患侧肺平均剂量有所降低,差异有统计学意义(t=8.67,P < 0.05);全肺低剂量体积V5有所降低,差异有统计学意义(t=5.31,P < 0.05);脊髓0.35 cm3体积的剂量有所降低,差异有统计学意义(t=2.44,P < 0.05);心脏15 cm3体积的剂量有所降低,差异有统计学意义(t=3.42,P < 0.05);食管5 cm3体积的剂量及气管4 cm3体积的剂量、小支气管0.5 cm3体积的剂量均略有降低,但差异无 统计学意义(P>0.05)。
表 2 肺癌患者有无OMU优化的危及器官受量比较( 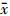 ± s
) ± s
)
|
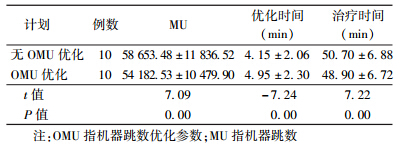
3.计划参数:肺癌患者有无OMU优化的计划参数比较结果列于表3。由表3可知,与无OMU优化计划相比,使用OMU优化计划时,机器跳数(MU)有所降低,差异有统计学意义(t=7.09,P < 0.05);优化时间有所增加,差异有统计学意义(t=-7.24,P < 0.05);治疗时间有所降低,差异有统计学意义(t=7.22,P < 0.05)。
表 3 肺癌患者有无OMU优化的计划参数比较( 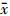 ± s
) ± s
)
|
Park等[8]研究表明,立体定向放疗较常规分割放疗,可获得更高的局部控制率和更低的并发症发生率。Borst等[9]和Stauder等[10]研究发现,立体定向放疗与常规分割放疗相比,2 级及以上放射性肺损伤发生率降低了6.7%。立体定向放射治疗引起的中央性和周围性肺损伤可以耐受,且未导致过度的早期肺损伤。在此优势基础上,利用OMU参数进一步优化降低体部立体定向放射治疗(SBRT)过程中正常肺组织的受量,使放射性肺损伤的发生率更加降低。
射波刀计划系统提供了OMU优化参数,当选用该参数参与顺序优化,会在迭代优化时将MU作为一个附加约束参与成本函数的优化,确保总MU只能随着后续优化步骤的执行而减少,最大程度减少了治疗的总MU数。为便于比较,两种优化方式最终的节点数和射野数相同,增加优化步骤使计划设计优化的平均时间增加了0.8 min,但治疗总MU数减少。总MU数的减少也使得平均治疗时间减少了1.8 min。治疗时间的缩短也将进一步提高患者治疗时的舒适度,降低不自主运动的机率,使治疗效率得以提高。
两种优化方法得出的计划都很好地保护了正常危及器官,食管、气管和主支气管、心包、脊髓、全肺都远小于美国医学物理学家协会(AAPM)101号报告所给出的限定值[7],其中肺、脊髓及心脏的剂量均因OMU优化有所降低,差异有统计学意义。全肺V5是接受5 Gy照射的肺体积占全肺体积的百分比,是正常肺组织"小剂量大体积"的最佳表现参数,所以,V5正在被越来越多的研究者认定为放射性肺损伤的最佳预测因子及独立预后因素[11, 12]。因此,本研究重点考察了OMU优化参数对V5的影响,总MU数的减少也使得肺平均剂量及V5都显著降低,正常肺组织得到了更好的保护,降低了放射性肺损伤发生的概率。在肺组织得到了更好保护的同时,肿瘤的处方剂量没有降低,都保证60 Gy的处方剂量包绕了95%以上的PTV体积。
两种优化方案,HI无变化,OMU优化后的CI、nCI略有降低,但是差异无统计学意义;PTV的平均剂量有所降低,分析结果,可能是由于总MU数的减少对PTV内部剂量贡献的MU数也相应减少,造成了平均剂量的降低。
综上,两种优化方案设计的计划都能满足SBRT临床要求的剂量分布。OMU优化后的治疗计划在满足PTV处方剂量的同时尽可能地降低了总MU和正常肺组织的受量,同时缩短了治疗时间,减小了机器的损耗,提高了治疗效率。所以OMU优化参数在制定射波刀肺癌的治疗计划中具有实际的临床意义和应用价值。
| [1] | 潘雪峰, 郑国宝, 邢红雨. 体部立体定向放射治疗112例非小细胞肺癌近期疗效观察[J]. 实用癌症杂志, 2011, 26(6):617-620. |
| [2] | 杜海峰, 魏长宏, 赵永生, 等. 体部立体定向放射治疗非小细胞肺癌的近期临床观察[J]. 西北国防医学杂志, 2015,(2):75-78. |
| [3] | 姜鹏, 王义善. 立体定向放射治疗在Ⅰ期非小细胞肺癌中的应用[J]. 实用医药杂志, 2015, 32(1):39-42. |
| [4] | 王志震, 袁智勇. 射波刀-低分割单次大剂量立体定向放射治疗的最佳执行者[J]. 中国肿瘤临床, 2009, 36(4):234-237. |
| [5] | 曹彦坤, 沈文斌, 祝淑钗. 肺低剂量区体积预测胸中下段食管癌放射性肺炎的价值[J]. 肿瘤防治研究, 2015, 42(1):32-36. |
| [6] | International Commission on Radiation Units and Measurements. ICRU report No 83:prescribing, recording, and reporting photon-beam intensity-modulated radiation therapy(IMRT)[R]. Oxford:ICRU, 2010. |
| [7] | Benedict SH, Yenice KM, Followill D, et al. Stereotactic body radiation therapy:the report of AAPM Task Group 101[J]. Med Phys, 2010, 37(8):4078-4101. |
| [8] | Park HJ, Griffin RJ, Hui S, et al. Radiation-induced vascular damage in tumors:implications of vascular damage in ablative hypofractionated radiotherapy(SBRT and SRS)[J]. Radiat Res, 2012, 177(3):311-327. |
| [9] | Borst GR, Ishikawa M, Nijkamp J, et al. Radiation pneumonitis in patients treated for malignant pulmonary lesions with hypofractionated radiation therapy[J]. Radiother Oncol, 2009, 91(3):307-313. |
| [10] | Stauder MC, Macdonald OK, Olivier KR, et al. Early pulmonary toxicity follwing lung stereotactic body radiation therapy delivered in consecutive daily fractions[J]. Radiother Oncol, 2011, 99(2):166-171. |
| [11] | Wang S, Liao Z, Wei X, et al. Analysis of clinical and dosimetric factors associated with treatment-related pneumonitis(TRP) in patients with non-small-cell lung cancer(NSCLC) treated with concurrent chemotherapy and three-dimensional conformal radiotherapy(3DCRT)[J]. Int J Radiat Oncol Biol Phys, 2006, 66(5):1399-1407. |
| [12] | 王静, 王平, 庞青松,等. 非小细胞肺癌三维适形放疗放射性肺损伤临床及剂量学因素分析[J]. 中华放射肿瘤学杂志, 2009, 18(6):448-451. |
 2015, Vol. 35
2015, Vol. 35