急性放射性心脏损伤(RIHD)是胸部肿瘤放疗常见的并发症,本组前期研究显示与心脏接受的剂量体积因素和TGF-β1等生物因素明显相关[1, 2, 3, 4]。目前RIHD与基础心功能状况的相关研究非常少见,本研究通过超声心动图对基础心功能各项指标与急性RIHD的相关性进行探讨,并动态观察放疗前、放疗结束、自放疗开始3个月的心功能变化情况,为RIHD的早期发现、早期干预,并降低心血管终点事件的发生提供参考数据。
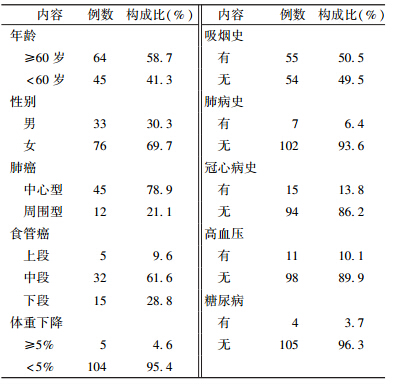
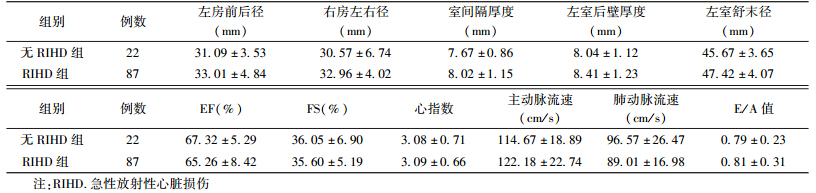
1. 一般资料:收集2008年12月至2012年8月于河北医科大学第四医院放疗科接受三维适形或调强放疗的胸部肿瘤患者共109例。其中肺癌患者57例(周围型12例病变接近或毗邻心脏),食管癌患者52例,临床资料见表1。
| 表1 109例患者一般临床资料 |
2. 纳入标准:经病理学确诊、初次接受放疗的肺癌、食管癌患者;年龄≤75岁,卡氏评分≥70;无严重心肺疾患。全部具有放疗前3个月、放疗结束及放疗开始3个月超声心动图检查,能正确评价心功能损伤者。
3. 排除标准:肺癌合并阻塞性肺炎患者;既往有严重慢性肺部疾病病史者,影像学资料提示有肺纤维化或肺部感染者。既往有严重心脏病史,并在3个月内急性发作;放疗前心功能检查示EF < 60%,超声心动图提示有心包积液;放疗前、放疗结束、自放疗开始3个月不能进行超声心动图及心功能检查,难以正确评价心脏功能损伤者;由于各种原因未能完成胸部放疗计划者。
4. 放疗方法及治疗计划:采用三维适形或调强放疗,PTV处方剂量为50~66 Gy,1.8~2.0 Gy/次,5次/周,共25~33次。心脏靶区勾画包括心肌组织和心包,不包括冠状动脉组织及大血管。限制心脏剂量为V40<100%;V45<67%;V60<33%;Dmean≤30 Gy。心脏物理评价指标为最大剂量(Dmax)、最小剂量(Dmin)、平均剂量(Dmean)、有效体积(Veff)、心脏体积因素V5、V10、V15、V20……V60和心脏剂量因素D5%、D10%、D15%、D20%……D100%等。
5. 基础心功能的检测:(1)心脏扩张指标,左房前后径、右房左右径、左室舒末径。(2)心肌肥厚指标,室间隔厚度、左室后壁厚度。(3)左室收缩功能指标,左室射血分数(LVEF)、左室短轴缩短分数(FS)。(4)左室舒张功能指标,舒张早期与心房收缩期左室充盈峰速度比值(E/A)。(5)心脏射血功能指标,心指数。(6)心脏瓣膜形态、功能指标,主动脉最大流速、肺动脉最大流速、瓣膜增厚、反流及狭窄。(7)心包病变,心包积液。
6. 随访及RIHD评价标准:分3个时间段对患者放疗前基础状态、放疗结束、自放疗开始3个月进行心肌酶、肌钙蛋白I、心电图、超声心动图及胸部CT检查,应用CTCAE 3.0标准[5]与RTOG标准[6]两种版本分别对急性RIHD分级进行评价。出现多项异常,按程度最重者进行分级。
7. 统计学处理:采用SPSS 13.0软件包进行统计学分析。计量资料采用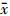 ±s表示,非正态分布资料采用两独立样本Mann-Whitney秩和检验,应用Logistic回归法进行单因素分析。应用Spearman法进行相关变量分析,放疗前、放疗结束及放疗开始3个月超声心动图比较采用重复测量设计资料的方差分析。P < 0.05为差异有统计学意义。
±s表示,非正态分布资料采用两独立样本Mann-Whitney秩和检验,应用Logistic回归法进行单因素分析。应用Spearman法进行相关变量分析,放疗前、放疗结束及放疗开始3个月超声心动图比较采用重复测量设计资料的方差分析。P < 0.05为差异有统计学意义。
1. 全组患者心脏受量情况:心脏Dmax、Dmin、Dmean、Veff分别为(61.3±15.2)、(25.3±27.4)、(21.3±12.8)、(10.7±9.0)Gy,心脏V5、V10、V20、V30、V40、V50、V60分别为(64.6±32.9)%、(56.4±33.6)%、(43.3±30.5)%、(31.6±24.4)%、(21.7±18.8)%、(12.4±11.4)%、(5.4±6.5)%,心脏D5%、D10%、D20%、D30%、D40%、D50%、D60%、D70%、D80%、D90%、D100%分别为(49.4±19.0)、(43.1±19.6)、(33.4±19.1)、(26.9±17.8)、(21.5±16.4)、(17.2±14.6)、(14.3±13.3)、(11.6±11.8)、(9.3±10.0)、(6.8±7.9)、(2.8±3.7) Gy。
2. 急性RIHD发生情况: 按CTCAE 3.0标准评价发生急性RIHD 87例(79.8%),其中1级73例,2级14例。具体表现为心电图异常54例,其中ST-T段改变26例,窦性心动过速21例,期前收缩8例,QRS波群低电压3例,心房纤颤1例;cTnI升高14例,心肌酶升高26例;心包积液5例。按RTOG标准评价发生急性RIHD 57例,总发生率为52.3%。其中1级48例,2级9例,心电图异常54例,心包积液5例。
3. 超声心动图情况:超声心动图显示全组患者左室收缩功能减低24例,舒张功能减低15例,瓣膜病变24例,其中反流(轻、中度反流)23例、狭窄(轻度)1例,全部为二尖瓣和(或)主动脉瓣改变,未见三尖瓣或肺动脉瓣反流与狭窄。以CTCAE 3.0标准诊断为1级和2级RIHD的超声心动图各项心脏参数指标见表2。
| 表2 急性RIHD患者超声心动图各项心脏参数指标 |
4. 临床因素与急性RIHD相关分析:以CTCAE 3.0作为诊断标准,单因素分析显示性别、年龄、体重下降、进食情况、是否吸烟、既往基础疾病包括肺病史、冠心病、高血压病史、糖尿病史等临床因素均非急性RIHD发生的影响因素差异无统计学意义(P > 0.05)。
5.基础心功能状况与急性RIHD的关系:应用CTCAE 3.0评价标准对基础心功能,包括心脏扩张、心肌肥厚、左室收缩功能、左室舒张功能、心脏射血功能、心脏瓣膜形态及功能等相关指标进行评价,发生急性RIHD患者与未发生RIHD患者组间基础心功能各项指标差异无统计学意义(P > 0.05),见表3。
表3 急性RIHD组与无RIHD组的基础心功能比较(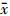 ±s) ±s)
|
6.放疗后急性观察期内心功能变化:左房前后径、主动脉流速、E/A值在放疗前、放疗结束、自放疗开始3个月差异有统计学意义(F=8.552,4.566,10.367,P < 0.05)。左房前后径、主动脉流速、E/A值放疗结束较放疗前分别下降了9.19%、7.56%、17.5%,自放疗开始3个月较放疗结束分别恢复7.05%、4.14%、7.58%,其中E/A下降和恢复变化幅度最大,见表4。
表4 109例患者放疗前后不同时间心功能的变化( ±s) ±s)
|
急性RIHD已成为胸部肿瘤患者放疗并发症之一,目前多数研究认为,急性RIHD受放疗物理剂量学因素(照射剂量及体积)、生化因素(血浆细胞因子的表达,如IL-1、TGF-β)、治疗方式的选择(照射技术、是否合并化疗),以及年龄、是否合并内科疾病等影响[1, 2, 3, 4, 7, 8, 9, 10]。有研究显示[11, 12],基础肺功能状况与放射性肺损伤相关,而目前国内外关于基础心功能状况对急性RIHD的影响研究较少,因此,本研究分别采用常用的急性RIHD判断标准CTCAE 3.0标准和RTOG标准评价109例胸部肿瘤患者急性RIHD,以期更全面、客观地评价基础心功能与急性RIHD的相关性,并观察急性期内患者心功能的变化。
本研究结果显示,发生心脏损伤和未发生心脏损伤的两组患者,无论从心脏扩张指标、心肌肥厚指标、左室收缩和舒张功能、还是心脏射血功能、基础心脏瓣膜形态和功能等多项指标进行分析比较,均未显示出基础心功能状况与急性RIHD有关,即使采用不同判断标准,基础心功能各项指标与急性RIHD发生仍无明显相关。说明胸部肿瘤放射治疗时,在按照入组标准、排除标准并对基础心功能如EF值、E/A值等进行了严格限定后,基础心功能状况似乎不是急性RIHD的主要影响因素,急性RIHD的发生主要还是受心脏接受辐射后的物理剂量学、生物学因素的影响较为明显。有关临床因素,本组前期研究未发现其是急性RIHD的影响因素[1],本研究进一步扩大入组病例,仍未发现RIHD的发生受到性别、年龄、是否合并内科疾病等临床因素的影响,但既往患冠心病史者中,RIHD发生率有高于无冠心病史的趋势,仍需进一步关注。但由于年老、合并基础疾病,尤其是伴有基础心脏疾病,或基础心功能较差的胸部肿瘤患者,放射治疗是其主要的局部治疗手段,因而临床工作中上述人群仍是需要密切观察的高危人群。
本组研究显示,在急性观察期内,超声心动图发现的心脏损伤中,瓣膜病变以主动脉受累最为常见,其次为二尖瓣,超声心动显示瓣膜增厚、挛缩、纤维化及伴发的狭窄和关闭不全。临床中放射治疗导致的瓣膜关闭不全而引起的反流似乎比狭窄更为多见,李大海等[13]研究结果显示,120例胸部放疗患者中,放疗后瓣膜形态改变及反流6例(5%),其中主动脉瓣反流3例,二尖瓣反流2例,主动脉瓣及二、三尖瓣各反流1例,均为轻、中度反流。本研究结果显示109例患者有24例出现瓣膜病变,发生率为22.0%,其中反流(轻、中度反流)23例、狭窄1例,为二尖瓣和(或)主动脉瓣改变,未见重度反流及狭窄,未见三尖瓣或肺动脉瓣反流与狭窄,但发生率高于李大海等[13]报道,需引起临床医生注意。另外,有研究表明,放射性心脏瓣膜病发生与时间有关,如Carlson等[14]回顾性研究显示,放疗后出现无症状的瓣膜功能不全平均间隔时间约为11.5年,而出现有症状的功能不全平均间隔时间约为16.5年。本研究虽然在急性期内观察到较多患者出现瓣膜病变,但多数患者无明显临床症状,考虑复查时间距首次放疗时间较短,而瓣膜病变是否会随着时间的延长而减轻或加重,需继续密切跟踪随访。
本组研究显示,放疗会使左心收缩和舒张功能受到一定程度影响[2]。郭建峰等[15]认为,在心脏损伤早期,心脏可通过自身的代偿来满足全身器官的供血,LVEF不会有明显改变,只有心肌严重受损或心脏整体功能受损时,才会出现左心室收缩功能指标的异常改变。所以,超声心动图在检测早期心脏损伤方面可能主要表现为舒张功能受损、左室舒张功能不全可能发生在收缩功能改变之前。张娜和张连仲[16]对40例胸部肿瘤放疗患者按放疗剂量进行对比分析,结果显示,30~40 Gy组、50~60 Gy组E/A值较对照组减低。50~60 Gy组的E/A值较30~40 Gy组减低。朱艳彬等[17]研究结果显示,LADs、LVDd、LVEF在放疗前后无明显差别,E/A在放疗后明显降低。本研究与上述报道较为一致,E/A值在放疗前、放疗结束、放疗开始3月变化最为明显,下降幅度最高达17.5%,而LVEF、FS在3个时间段观察差异均无统计学意义。说明在早期心肌损害中,LVEF或FS变化可能并不是敏感指标,心功能损伤主要表现为舒张功能受损。考虑放疗导致的心肌收缩力降低可使EF明显低于正常人,但由于同时合并反流,左心室每搏量包括了射向主动脉的前向每搏量和反流量,而EF也包含了反流分数,此时即使EF降低,仍可能高估真正的左心室收缩功能损伤状况,这可能是导致LVEF、FS在本研究3个时间点比较差异无统计学意义的原因之一。值得注意的是,本组研究发现主动脉流速作为反映左室收缩功能指标之一,其流速随着左室收缩功能先降低后升高的变化趋势而相应变化,且在3个时间点差异有统计学意义。因此,对于其是否可作为左室收缩功能受损的早期预后监测指标需进一步关注。
左房内径变化体现左房负荷,当负荷增大时,多引起左房内径增大,目前,未见关于放疗引起的左房内径变化情况的相关报道,本组患者放疗引起的心脏损伤左房内径减小,说明左房负荷放疗后有所减少,其临床意义需扩大病例数并延长随访期进一步观察。本研究还观察到左房前后径、E/A值放疗结束较放疗前降低,但自放疗开始3个月后较放疗结束有所升高,说明放疗对心脏损伤是一个渐变过程,随着时间延长受损心脏的心功能可能得到逐步改善,但在急性期内尚不能完全恢复到放疗前水平。
综上所述,基础心功能状况与急性RIHD的发生似乎无明显相关。放疗导致的瓣膜病变以二尖瓣和(或)主动脉瓣多见,关闭不全造成的反流多于瓣膜狭窄。放射治疗引起的心功能损伤以E/A下降和恢复变化幅度最大,并在急性期内未能恢复到正常水平。
| [1] | 王军, 王祎, 刘青, 等. 三维放疗急性放射性心脏损伤类型及影响因素分析[J]. 中华放射肿瘤学杂志, 2013, 22(3):213-216. |
| [2] | 王军,龙书敬,景绍武,等.胸部肿瘤放疗后急性左心室功能损伤剂量体积因素分析[J].中华放射肿瘤学杂志,2014, 23(4): 326-330. |
| [3] | 龙书敬,王军,王祎,等.剂量-体积参数指标对晚期放射性心包积液发生的影响[J].中华放射肿瘤学杂志,2015,24(3):241-244. |
| [4] | 王祎, 王军, 程云杰, 等. 血清细胞因子TGF-β1和IL-1β表达水平对急性放射性心脏损伤发生的影响[J]. 中华放射医学与防护杂志, 2012, 32(5): 488-491. |
| [5] | National Cancer Institute.Common.Terminology Criteria for Adverse Events v3.0 (CTCAE)[S] [2003-06-10].http://electronic_applications/docs/ctcaev3.pdf. |
| [6] | Cox JD, Stetz J, Pajak TF. Toxicity Criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995,31(5):1341-1346. |
| [7] | Filopei J, Frishman W. Radiation-induced heart disease[J]. Cardiol Rev, 2012, 20(4):184-188. |
| [8] | Stewart FA, Seemann I, Hoving S, et al. Understanding radiation-induced cardiovascular damage and strategies for intervention[J]. Clin Oncol, 2013, 25(10): 617-624. |
| [9] | 曾国彬, 陈碧茵, 陈樟树. 167例胸部放疗患者的心脏损伤临床分析[J]. 肿瘤基础与临床, 2013,26(3):231-232. |
| [10] | Tamari K, Isohashi F, Akino Y, et al.Risk factors for pericardial effusion in patients with stage I esophageal cancer treated with chemoradiotherapy[J]. Anticancer Res,2014 ,34(12):7389-7393. |
| [11] | Palma DA, Senan S, Tsujino K, et al. Predicting radiation pneumonitis after chemoradiation therapy for lung cancer: an international individual patient data meta-analysis[J]. Int J Radiat Oncol Biol Phys, 2013,85(2):444-450. |
| [12] | Kim M, Lee J, Ha B, et al. Factors predicting radiation pneumonitis in locally advanced non-small cell lung cancer[J]. Radiat Oncol J, 2011,29(3): 181-190. |
| [13] | 李大海,姜志荣,陆海军,等.超声心动图检查评价胸部放疗致肿瘤病人心脏损害的临床价值[J].青岛大学医学院学报,2007,43(3):227-233. |
| [14] | Carlson RG, Mayfield WR, Normann S, et al. Radiation-associated valvular disease[J]. Chest,1991,99(3):538-545. |
| [15] | 郭建锋, 黄敏, 吴锦昌, 等. 肌钙蛋白I联合超声心动图评价兔直线加速器单次照射后心脏损伤的实验研究[J]. 南京医科大学学报, 2012, 32(10): 1381-1385. |
| [16] | 张娜,张连仲.应用心肌速度梯度评价胸部放疗患者左室功能的研究[J].现代中西医结合杂志,2013,22(5):471-473,578. |
| [17] | 朱艳彬, 吕冬燕, 姜欣. 三维彩超诊断胸部放疗早期心脏损伤40例分析[J]. 中国误诊学杂志, 2011, 11(31): 7731. |
 2015, Vol. 35
2015, Vol. 35