2. 江南大学附属医院;
3. 苏州大学物理学院
等离子体医学是近几年兴起的,且具有重大研究前景。目前,国内外已在多个应用领域取得了成果,如血液凝固、灭菌、口腔治疗、皮肤病治疗、杀灭癌细胞等[1, 2, 3, 4]。等离子体对肿瘤细胞杀伤的研究刚刚起步,它能够诱导癌细胞凋亡[5, 6, 7, 8, 9],促使肿瘤细胞从基底脱落,抑制肿瘤的浸润和转移[10, 11]。然而,关于等离子体放射增敏作用的研究少见报道。本实验初步探讨低温等离子体对HepG2细胞、A549细胞及HeLa细胞放射敏感性的影响及其可能的机制。
材料与方法
1. 细胞、试剂、仪器:人非小细胞肺癌细胞系A549、人肝癌细胞系HepG2、人宫颈癌细胞系HeLa均由苏州大学樊赛军教授长江学者实验室惠赠,购自美国细胞收藏中心(American Type Culture Collection,ATCC),由该实验室培养和保存。DMEM培养基干粉、胎牛血清(FBS)、二甲基亚砜(DMSO)、胰酶粉末购自美国 GIBCO公司,标准蛋白质分子量、RIPA蛋白裂解液、30%丙烯酰胺凝胶液(Acary-Bis)、Tris-HCl、四甲基乙二胺(TEMED)、过硫酸铵(APS)、吐温-20(Tween-20)、甘氨酸(Glycine)、十二烷基磺酸钠(SDS)、碘化丙啶(PI)、Annexin-V FITC、活性氧检测试剂盒均购自上海碧云天生物技术有限公司。高纯氩气(Ar)(99.999%)和高纯氧气(O2)(99.999%)购自上海五钢气体有限公司。气体质量流量控制器(D08-1F)购自北京七星华创电子有限公司,AvaSpec-2048型八通道光纤光谱仪购自荷兰Avantes公司。
2. 低温等离子体产生的条件:放电电压3 kV,放电电流40 mA,高纯氩气体流量为3 L/min,高纯氧流量为20 ml/min,产生的低温等离子体束约为1~2 cm。低温等离子体射流装置的基本原理为高纯氩气和高纯氧气混合进入石英玻璃管,由内外电极产生的高电压对混合气体进行电离,产生等离子体射流。
3. 光谱仪测定等离子体放电的光谱:采用AvaSpec-2048型八通道光纤光谱仪测定Ar/O2微等离子体放电的发射光谱(OES),测量波长范围为200~1 000 nm,从而确定等离子体中的成分。微等离子体放电的发射光谱结果波长在777.2、794.8 nm处出现氧的谱线,在409.4和500.6 nm处出现氮的谱线,在222.5、246.1和272.9 nm处出现一氧化碳(CO)的谱线,并出现许多Ar的谱线。因此,放电等离子体中存在活性Ar、活性氧(ROS)、活性氮(RNS)和CO。
4. 细胞培养与照射:用含10%胎牛血清、10 000 U/ml青霉素、1%非必需氨基酸、10 g/ml链霉素的DMEM全培养基培养HepG2、A549及HeLa细胞系;37℃,5%CO2饱和湿度培养箱,每2~3天传代1次,取对数期生长细胞用于实验。照射时,使用6 MV X射线照射(德国西门子公司Primus医用直线加速器),细胞表面覆盖1.5 cm厚补偿膜,吸收剂量率为2 Gy/min,机架角为180°,源靶距为1 m,照射野为10 cm×10 cm。
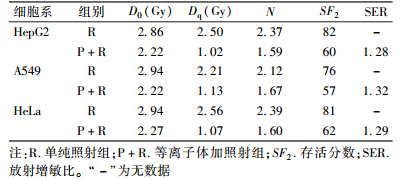
5. 克隆形成率观察低温等离子体对3种细胞的放射增敏作用:将细胞分为单纯照射组(R)和等离子体加照射组(P+R)。取对数生长期的A549、HepG2、HeLa细胞,经胰酶消化后制成单细胞悬液,接种于6孔培养板内,每个剂量点接种的细胞数分别为100、100、200、300、400、600 和 800,每组3个复孔。等离子体处理时间分别为HepG2细胞18 s,HeLa细胞20 s,A549细胞21 s,处理后将DMEM细胞培养液加至3 ml,将两组细胞用6 MV X射线给予不同剂量(0、0.5、1、2、4、6和8 Gy)照射。照射后在培养箱中继续培养12~14 d,弃培养基,PBS洗两次,无水甲醇固定约30 min,弃无水甲醇,PBS洗两次,晾干,姬姆萨染色,计数肉眼观察到的集落细胞数。细胞存活分数(SF)=照射组细胞的克隆形成率(PE)/对照组细胞的克隆形成率(PE),PE为>50个细胞的克隆细胞数/接种细胞个数,SF2为照射2 Gy时的存活分数。使用Graphpad Prism 5软件,按单击多靶模型SF=1-(1-eD/D0)N,拟合存活曲线,计算反映细胞敏感性的参数D0、Dq、N、SERD0值。
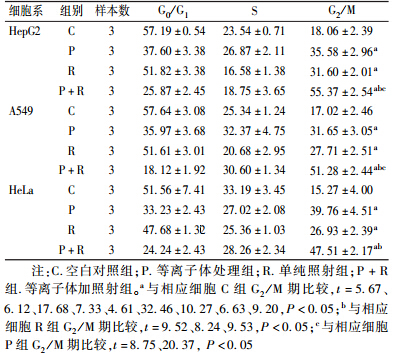
6. 细胞周期分析:将每种细胞分为空白对照组(C)、等离子体处理组(P)、单纯照射组(R)和等离子体加照射组(P+R)。取对数期生长的细胞以1×105/孔接种至6孔板内,培养至细胞生长贴壁融合70%~80%。将6孔板置于喷嘴下方照射等离子体,处理时间为HepG2细胞18 s,HeLa细胞20 s,A549细胞21 s,每组照射3孔癌细胞后,将P组细胞放在培养箱中继续培养24 h。R和P+R两组细胞置于直线加速器下,用6 MV X射线照射,细胞的吸收剂量为4 Gy,照射后在培养箱中继续培养24 h。后用胰酶消化,离心半径6 cm,1 000 r/min,离心5 min。用PBS洗两次后,加4 ml 4℃预冷的70%冰乙醇固定过夜,检测之前离心去上清,PBS洗两次,加入500μl PI溶液中,避光放置30 min后用流式细胞仪检测。
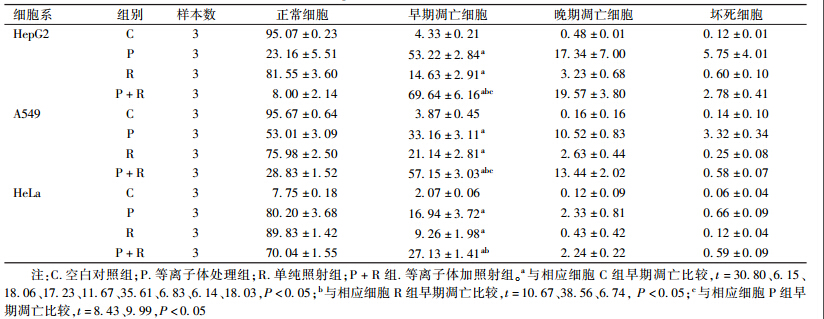
7. 磷脂酰丝氨酸外翻法(Annexin-V和PI双染法)检测细胞凋亡:分组和处理方法同细胞周期实验,各种方法处理后培养24 h,然后用胰酶消化,离心半径6 cm,3 500 r/min,离心5 min。离心后去上清,加入500μl的Annexin-V结合液悬浮细胞,加入5μl的PI和Annexin-V FITC,吹打均匀,避光孵育10 min后,用流式细胞仪检测。
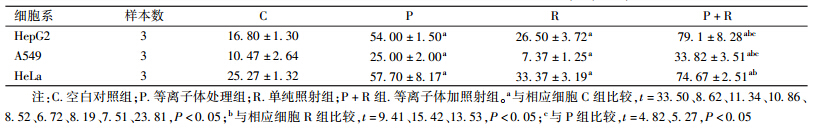
8. 细胞内活性氧(ROS)含量的检测:分组和处理方法同细胞周期实验,[JP2]各种方法处理完培养24 h,后将细胞消化、离心、去上清,加入1 ml不含血清的DMEM培养基,加入1μl DCFH-DA,使其浓度为10 μmol/L,混匀,使DCFH-DA充分与细胞接触,置于培养箱中孵育30 min,离心半径6 cm,2 500 r/min,离心5 min,用PBS洗3次,用流式细胞仪检测。 [JP]
9. Western blot检测相关蛋白表达:收集细胞并转至于1.5 ml的Eppendorf管中,离心半径3 cm,2 500 r/min,离心5 min,弃上清,并加入适量细胞裂解液,吹打混合均匀,置冰上1~2 h后,于4℃环境下,离心半径3 cm,13 000 r/min离心5 min,取上清液至新的Eppendorf管,采用分光光度计检测样品蛋白含量。加入适量蛋白上样缓冲液(5×)混匀,放置在恒温混匀器上,100℃ 5 min,将蛋白电泳后转至醋酸纤维膜上,置于封闭液[5%脱脂奶粉,1×磷酸盐吐温(PBST)缓冲液]中封闭1 h。加入一抗封闭液封闭1 h,PBST洗3次,置于水平摇床上摇晃,每次间隔15 min;加入辣根过氧化酶(HRP)标记的二抗孵育1 h。PBST洗膜3次,每次间隔15 min;取等体积EZ-ECL A液、B液,混匀,将PVDF膜浸入混合液中约5 min,显影、定影,扫描分析。
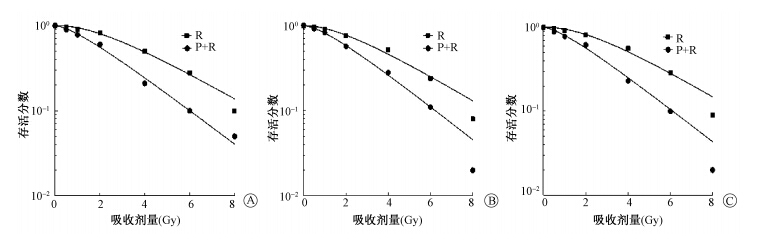
10. 统计学处理:采用SPSS 19.0软件包分析,计量资料以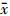 ±s表示,组间相关性采用相关与回归分析,组间比较采用t检验。P < 0.05为差异有统计学意义。
±s表示,组间相关性采用相关与回归分析,组间比较采用t检验。P < 0.05为差异有统计学意义。
结 果
1. 低温等离子体对不同剂量照射的3种细胞系的放射敏感性的影响:存活曲线参数列于表1,存活曲线示于图1。
| 表1 低温等离子体对HepG2、A549及HeLa细胞系的放射增敏效应 |
|
图1 低温等离子体对HepG2(A)、A549(B)及HeLa(C)细胞系的放射敏感性的影响 注:R.单纯照射组;P+R.等离子体加照射组 |
2. 不同处理因素对3种细胞细胞周期的影响:结果如表2所示。在4 Gy剂量下,3种细胞系P+R组G2/M期比例与R组比较明显增高(t=9.52、8.24、9.53,P < 0.05);HeG2细胞和A549细胞P+R组G2/M期比例与P组比较明显升高(t=8.75、20.37,P < 0.05)。HeLa细胞中P+R组G2/M期比例与P组比较,差异无统计学意义(P > 0.05)。
表2 不同处理因素对HepG2、A549及HeLa细胞周期的影响(%,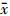 ±s) ±s)
|
3. 不同处理因素对3种细胞凋亡的影响:结果列于表3。由表3可知,3种细胞系中P+R组早期凋亡比例与R组比较明显升高(t=10.67、38.56、6.74, P < 0.05),HeG2和A549细胞P+R组早期凋亡比例与P组比较明显升高(t=8.43、9.99,P < 0.05),HeLa细胞中P+R组早期凋亡比例与P组比较,差异无统计学意义(P > 0.05)。
表3 不同处理因素对HepG2、A549及HeLa细胞凋亡的影响(%,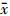 ±s) ±s)
|
4. [JP2]不同处理因素对癌细胞内ROS含量的影响:结果列于表4。由表4可知,3种细胞系中P+R组与R组比较,ROS明显升高(t=9.41、15.42、13.53,P < 0.05)。HeG2和A549细胞P+R组与P组比较ROS明显升高(t=4.82、5.27,P < 0.05),HeLa细胞中P+R组与P组比较,差异无统计学意义(P > 0.05)。
表4 不同处理因素对3种不同癌细胞内活性氧含量的影响(个,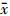 ±s) ±s)
|
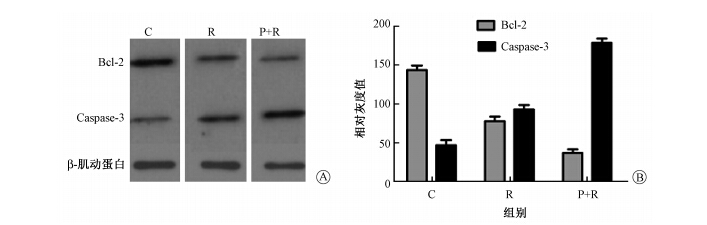
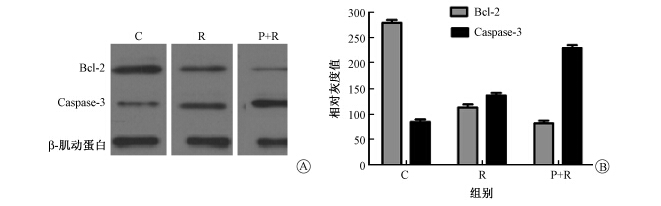
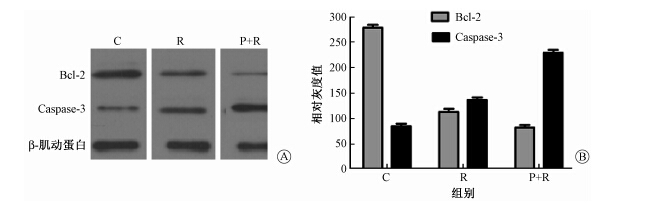
5. Western blot法检测低温等离子联合辐射对3种细胞中Bcl-2、Caspase-3蛋白表达的影响:结果示于图2~图4。由图2~图4可见,3种细胞中,R组Bcl-2蛋白条带较P+R组条带灰度更深,面积更大,提示前者Bcl-2蛋白表达更高;而Caspase-3蛋白表达则相反,P+R组细胞Caspase-3蛋白表达较R组更高。
|
图2 不同处理后HepG2细胞Bcl-2和Caspase-3的蛋白表达 A.电泳图;B.相对灰度 注:C.空白对照组;R.单纯照射组;P+R组.等离子体加照射组 |
|
图3 不同处理后A549细胞Bcl-2和Caspase-3的蛋白表达 A.电泳图;B.相对灰度 注:C.空白对照组;R.单纯照射组;P+R组.等离子体加照射组 |
|
图4 不同处理后HeLa细胞Bcl-2和Caspase-3的蛋白表达 A.电泳图;B.相对灰度 注:C.空白对照组;R.单纯照射组;P+R组.等离子体加照射组 |
讨 论
低温等离子体是为了区别于受控热核聚变产生的高温等离子体,高温等离子体的温度要达到10 MeV以上,如此高温度的物质,在通常条件下无法应用[12]。低温等离子体中含有多种不同的活性成分,如紫外线(UV)、带电粒子(电子、正负离子等)、化学活性粒子(活性氧和活性氮等)等,依其使用的工作气体及等离子体源的不同,其成分和含量也各不相同[13, 14, 15, 16, 17, 18, 19],这些成分可能与抗肿瘤作用有关。
目前,有关低温等离子体用于放射增敏剂的研究尚未见报道,本研究将HePG2细胞、A549细胞及HeLa细胞作为研究对象,阐明了低温等离子体对人体不同部位不同来源的恶性肿瘤具有放射增敏作用,其机制可能为:
(1)抑制照射后亚致死损伤修复:亚致死损伤修复主要反映在细胞存活曲线的肩段上。结合集落形成实验结果,3种癌细胞P+R组中D0、Dq、N值均明显降低,曲线左移,且曲线较为平直,"肩区"不明显,提示细胞亚致死损伤修复能力受到抑制,由此推测,低温等离子体对肿瘤细胞亚致死性损伤的修复抑制可能是其放射增敏机制之一。
(2)细胞周期阻滞:在细胞周期中,G2/M 期细胞对放射最敏感,其次为G1期细胞,S期细胞最不敏感,本研究运用流式细胞仪经不同因素处理两种癌细胞的周期分布,结果表明,与C组比较,P组和R组细胞周期阻滞在G2/M期,其原因在于辐射可使癌细胞再分布,使肿瘤细胞增殖周期加快,增殖比例提高,使更多的细胞进入放射敏感时相;同样,癌细胞经低温等离子体处理后,也发生了细胞周期再分布,更多的细胞进入放射敏感时相G2/M期;而P+R组G2/M期比例较R组和P组明显升高,提示低温等离子体联合辐射可以通过改变细胞再分布,诱导G2/M期阻滞,进而提高了电离辐射对肿瘤细胞的敏感性,提高其杀伤效果。
(3)ROS介导的细胞凋亡:Yan等[20]发现肝癌细胞HepG2经等离子体处理后,肝癌细胞增殖受到明显抑制,细胞内凋亡通路被激活,细胞内NO和ROS水平增高,Caspase-3、9的活性明显变强,下调了Bcl-2水平,而上调了Bax水平,最终导致肿瘤细胞凋亡。本实验也证实了低温等离子体可以诱导Caspase-3表达,下调Bcl-2的表达;联合辐射可以使这种作用加强。因此,低温等离子体联合辐射可以通过Bax/Bcl-2和Caspase-3途径诱导肿瘤细胞凋亡。为了进一步证实上述结果,本研究采用DCFH-DA作为荧光探针测定细胞内ROS水平和磷脂酰丝氨酸外翻法检测细胞凋亡,结果显示,在低温等离子体处理HePG2细胞和A549细胞后,3种癌细胞内P+R组ROS含量较R组明显增加,凋亡率与R组相比也明显升高,R组和P组的ROS含量均较C组显著提高。综上结果,提示电离辐射、低温等离子体单独和联合使用均可以诱导细胞内ROS水平和细胞凋亡率增加,二者联合的效果更加明显。因此,推测低温等离子体联合辐射可以提高细胞内ROS水平,通过Bax/Bcl-2和Caspase-3途径进一步诱导肿瘤细胞凋亡是低温等离子体的放射增敏机制之一。
本实验首次证实了低温等离子体对上述HepG2细胞、A549细胞及HeLa细胞具有放射增敏作用,并具有一定的毒性作用,为临床肝癌、非小细胞肺癌及宫颈癌等不同部位、不同器官来源恶性肿瘤的治疗提供了新的思路,但低温等离子体确切的抗肿瘤机制还需要进一步研究。
| [1] | Morfill GE, Kong MG, Zimmermann JL. Focus on plasma medicine[J]. New J Phys, 2009, 11(11):115011. |
| [2] | Stoffels E, Sakiyama Y, Graves DB. Cold atmospheric plasma:charged species and their interactions with cells and tissues[J]. IEEE Trans Plasma Sci, 2008, 36(4):1441. |
| [3] | Georgescu N, Lupu AR. Tumoral and normal cells treatment with high-voltage pulsed cold atmospheric plasma jets[J]. IEEE Trans Plasma Sci, 2010, 38(8):1949-1955. |
| [4] | Zirnheld JL, Zucker SN, DiSanto TM, et al. Nonthermal plasma needle: development and targeting of melanomacells[J]. IEEE Trans Plasma Sci, 2010, 38(4):948-952. |
| [5] | Sensenig R, Kalghatgi S, Cerchar E, et al. Non-thermal plasma induces apoptosis in melanoma cells via production of intracellular reactive oxygen species[J]. Ann Biomed Eng, 2011, 39(2): 674-687. |
| [6] | [ZK(]Hall EH, Schoenbach KH, Beebe SJ. Nanosecond pulsed electric fields induce apoptosis in p53-wildtype and p53-null HCT116 colon carcinoma cells[J]. Apoptosis, 2007, 12(9):[LL]1721-1731.] |
| [7] | Kim CH, Bahn JH, Lee SH, et al. Induction of cell growth arrest by atmospheric non-thermal plasma in colorectal cancer cells[J]. J Biotech, 2010, 150(4):530-538. |
| [8] | Zucker SN, Zirnheld J, Bagati A, et al. Preferential induction of apoptotic cell death in melanoma cells as compared with normal keratinocytes using a non-thermal plasma torch[J]. Cancer Biol Therap, 2012, 13(13):1299-1306. |
| [9] | Sensenig R, Kalghatgi S, Cerchar E, et al. Non-thermal plasma induces apoptosis in melanoma cells via production of intracellular reactive oxygen species[J]. Ann Biomed Eng, 2011, 39(2): 674-687. |
| [10] | Kalghatgi S, Kelly CM, Cerchar E, et al. Effects of non-thermal plasma on mammalian cells[J]. PLoS One, 2011, 6(1): e16270. |
| [11] | Huang J, Li H, Chen W, et al. Dielectric barrier discharge plasma in Ar/O2 promoting apoptosis behavior in A549 cancer cells[J]. Appl Phys Lett, 2011, 99(2): e253701. |
| [12] | 杜世刚. 等离子体物理[M]. 北京:原子能出版社,1998:1-20. |
| [13] | Ayan H, Fridman G, Staack D. Heating effect of dielectric barrier discharges for direct medical treatment[J]. IEEE Trans Plasma Sci, 2009, 37(1):113-120. |
| [14] | Erofeev MV, Kieft IE, Sosnin EA. UV excimer lamp irradiation of fibroblasts: the influence on antioxidant homeostasis[J]. IEEE Trans Plasma Sci, 2006, 34(4): 1359-1364. |
| [15] | Lerouge S, Wertheimer MR, Yahia LH. Plasma sterilization: a review of parameters, mechanisms, and limitations[J]. Plasmas Polym, 2001, 6(3): 175-188. |
| [16] | Soloshenko IA, Tsiolko VV, Khomich VA, et al. Sterilization of medical products in low-pressure glow discharges[J]. Plasma Phys Rep, 2000, 26(9):792-800. |
| [17] | Birmingham JG. Mechanisms of bacterial spore deactivation using ambient pressure nonthermal discharges[J]. IEEE Trans Plasma Sci, 2004, 32(4):1526-1531. |
| [18] | Wang S, Schulz-von der Gathen V, Dobele HF. Discharge comparison of nonequilibrium atmospheric pressure Ar/O2 and He/O2 plasmajets[J]. Appl Phys Lett, 2003, 83(16): 3272-3274. |
| [19] | Hury S, Vidal DR, Desor F, et al. A parametric study of the destruction of Bacillus spores in low pressure oxygen-based plasmas[J]. Lett Appl Microbiol, 1998, 26(6): 417-421. |
| [20] | Yan X, Zou F, Zhao SS. On the mechanism of plasma inducing cell apoptosis[J]. IEEE Trans Plasma Sci, 2010, 38(9): 2451-2457. |
 2015, Vol. 35
2015, Vol. 35