放射治疗是治疗肿瘤的主要手段之一,肿瘤细胞的辐射敏感性直接影响肿瘤的放疗效果。研究提高肿瘤细胞辐射敏感性的药物,对提高肿瘤放疗的疗效具有重要意义。金纳米粒子(AuNPs)原子序数高、化学性质稳定,无明显急性生物毒性[1],且容易制备。肿瘤组织中,AuNPs的含量增加,可以增加肿瘤组织的吸收剂量,从而增强辐射损伤效应。而纳米金粒子增敏比与进入细胞的纳米金粒子的浓度相关[2]。细胞对AuNPs的吸收与其表面修饰密切相关[3]。本研究以人宫颈癌HeLa细胞为对象,分别用聚乙二醇修饰的AuNPs(AuNPs@PEG)及聚乙二醇和核酸适配体AS1411修饰的AuNPs(AuNPs@PEG-AS1411)处理HeLa细胞,研究其对HeLa细胞辐射敏感性的影响。
1.主要试剂和仪器:氨基-聚乙二醇-氨基(NH2-PEG-NH2)(相对分子质量2×103)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、脂肪酸甲酯磺酸盐(MES)购自苏州博美达试剂仪器有限公司;柠檬酸三钠、3-巯基丙酸(MPA)、N-羟基琥珀酰亚胺(NHS)购自美国Sigma公司;氯金酸(HAuCl4)、透析膜(相对分子质量1×103)、羧基-AS1411(序列为5' COOH-TTGGTGGTGGTGGTTGTGGTGGTGGTGG 3')及对照序列cApt(序列为5' COOH-TTCCTCCTCCTCCTTCTCCTCCTCCTCC 3')购自上海生工公司;DMEM细胞培养基、小牛血清购自美国GIBCO公司;细胞增殖及细胞毒性检测试剂盒(CCK-8)购自上海同仁化学研究所;多功能酶标仪(美国Bio-Tek公司,Synergy 2)、纳米粒度分析仪(英国马尔文公司,Zetasizer Nano ZS90)、电感耦合等离子体质谱仪(ICP-MS,美国Thermo公司,ELEMENT 2)。
2.细胞培养与照射条件:人宫颈癌HeLa细胞为本实验室保存,置于含有10%的小牛血清的DMEM培养基中,在37℃、5%CO2饱和湿度条件下培养,培养瓶内单层传代培养,取对数生长期细胞进行实验。应用美国Radsource公司RS 2000 PRO型X射线生物照射仪照射细胞,射线能量160 kVp,吸收剂量率1.15 Gy/min,源靶距40 cm。
3. AuNPs的制备:将HAuCl4溶液稀释成0.01%浓度,取200 ml加热至沸腾;在搅动下加入4 ml 1%的柠檬酸三钠水溶液,继续加热煮沸15 min。冷却至室温后,4℃避光保存备用。制得的AuNPs和AuNPs@PEG的粒径分别为44和48 nm,AuNPs@PEG-AS1411和AuNPs@PEG-cApt的均为50 nm。
4. AuNPs@PEG的制备:根据参考文献[4]提供的方法制备AuNPs@PEG。用纳米粒度分析仪检测AuNPs@PEG的粒径,ICP-MS检测AuNPs@PEG溶液的浓度。
5. AuNPs@PEG-AS1411和AuNPs@PEG-cApt的制备:取7 ml 50 mmol/L MES溶液,用K2CO3溶液调其pH值为6.0左右,加入7 mg EDC和10.5 mg NHS,搅拌30 min,混合均匀。从中取出0.7 ml溶液与0.3 ml 0.1 mmol/L AS1411溶液混合均匀,搅拌30 min。然后,加入到已制得的130 ml AuNPs@PEG溶液中,搅拌24 h。后将所得液体在4℃、60 000×g离心15 min,重复离心3次,得到AuNPs@PEG-AS1411溶液。用纳米粒度分析仪检测AuNPs@PEG-AS1411的粒径,用ICP-MS检测AuNPs@PEG-AS1411溶液的浓度。用cApt取代AS1411制备AuNPs@PEG-cApt溶液。
6.细胞内AuNPs含量检测:细胞分为AuNPs@PEG组、AuNPs@PEG-AS1411组和AuNPs@PEG-cApt组3组。每组HeLa细胞制成细胞悬液,接种于6孔板。待细胞铺满孔底80%后,分别加Au浓度为10 mg/L的AuNPs@PEG、AuNPs@PEG-AS1411、AuNPs@PEG-cApt培养基,每组设3个复孔。培养24 h后,弃药物及培养基,PBS洗3次,胰酶消化,加3 ml培养基吹打为细胞悬液。计数每孔细胞的数量。离心半径15 cm,1 000 r/min离心5 min,收集细胞,用ICP-MS测量每个样本中Au的浓度。根据纳米粒子粒径,样本中细胞数目和金浓度计算出进入细胞中AuNPs数量。
7.细胞毒性实验:取对数生长期细胞,制成单细胞悬液,接种于96孔板,根据培养时间确定接种细胞数量,培养24 h组接种5 000/孔,培养48 h组接种3 000/孔,培养72 h组接种1 000/孔,每孔含100 μl细胞培养基。接种细胞分空白对照组(培养基,不含细胞)、对照组(培养基+细胞)和实验组(AuNPs@PEG、AuNPs@PEG-AS1411和AuNPs@PEG-cApt+培养基+细胞)。接种细胞24 h后,在实验组细胞中分别加入AuNPs@PEG、AuNPs@PEG-AS1411、AuNPs@PEG-cApt,使其终浓度分别为5和10 mg/L,每组设6个复孔。在37°C、5%CO2及饱和湿度条件下分别继续培养24、48 和72 h后, 取出培养板,弃培养基,每孔加入90 μl新的DMEM培养基和10 μl CCK-8溶液,放入37°C、5%CO2饱和湿度条件下继续孵育2 h。630 nm波长为参比波长,在多功能酶标仪上检测各孔450 nm波长吸光度(A)值。细胞存活率(%)=(实验组平均A值-空白对照组平均A值)/(对照组平均A值-空白对照组平均A值)×100%。
8.克隆形成法测量X射线照射后HeLa细胞的存活率:取对数生长期细胞,制成单细胞悬液,根据照射剂量接种不同的细胞数。吸收剂量为0、2、4、6和8 Gy时分别以500、500、2 000、6 000和10 000/孔密度种入直径为60 mm培养皿中,每组每个剂量点设3个平行样。细胞分AuNPs@PEG组、AuNPs@PEG-AS1411组和AuNPs@PEG-cApt组。细胞接种后培养24 h,弃培养基,各组加含金浓度分别为0、5和10 mg/L的相应修饰的AuNPs培养基,继续培养24 h,用160 kVp X射线照射各组细胞,吸收剂量分别为0、2、4、6和8 Gy。照射后继续培养6 h后,换新鲜纯培养基继续培养10 d。甲醇固定0.5 h,姬姆萨染色0.5 h,计数50个细胞以上的细胞集落。计算细胞存活分数(SF),SF=受照细胞克隆形成率/未照射细胞克隆形成率。细胞克隆形成率(%)=克隆形成数/接种细胞数×100%。根据单击多靶模型SF=1-(1-e-D/D0)N,拟合细胞存活曲线,阈剂量Dq=D0lnN。根据D0和Dq值,分别计算出SERD0和SERDq。
9.统计学处理:结果用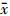 ± s表示,采用SPSS 16.0软件进行分析。组间比较采用方差分析,多重比较采用LSD-t检验。P < 0.05为差异有统计学意义。
± s表示,采用SPSS 16.0软件进行分析。组间比较采用方差分析,多重比较采用LSD-t检验。P < 0.05为差异有统计学意义。
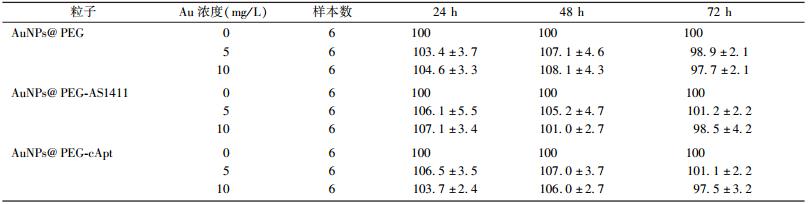
1.3种纳米粒子的细胞毒性:表1为CCK-8法得到的AuNPs@PEG、AuNPs@PEG-AS1411和AuNPs@PEG-cApt对HeLa细胞存活率影响的实验结果。3种AuNPs对HeLa细胞的存活率没有明显的影响(P>0.05),表明AuNPs@PEG、AuNPs@PEG-AS1411和AuNPs@PEG-cApt对HeLa细胞的急性毒性很小。
表 1 3种不同浓度的纳米粒子不同培养时间HeLa细胞的存活率(%,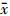 ± s) ± s)
|
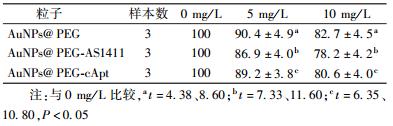
表2为用克隆形成法得到的AuNPs@PEG、AuNPs@PEG-AS1411和AuNPs@PEG-cApt处理细胞24 h,对HeLa细胞存活率影响的实验结果。结果显示,HeLa细胞的存活率明显降低。表明这3种纳米粒子对HeLa具有长期毒性。
表 2 不同浓度3种纳米粒子作用后10 d HeLa细胞存活率(%,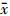 ± s) ± s)
|
由表1和表2的实验结果可以看出,浓度达到10 mg/L时,AuNPs@PEG、AuNPs@PEG-AS1411、AuNPs@PEG-cApt对HeLa细胞急性毒性很小,但存在长期毒性。
2.细胞内3种AuNPs的含量:用含Au浓度为10 mg/L的AuNPs@PEG、AuNPs@PEG-AS1411、AuNPs@PEG-cApt DMEM培养基培养HeLa细胞24 h后,进入到每个细胞中的AuNPs数分别为(3.09±0.42)×103、(11.67±0.33)×103、(3.68±0.37)×103。结果显示,每个细胞中AuNPs@PEG-AS1411含量是AuNPs@PEG的3.8倍(t=27.8,P < 0.01),而每个细胞中AuNPs@PEG和AuNPs@PEG-cApt含量差异无统计学意义,表明AS1411可以促进细胞对纳米金粒子的吸收。
3.3种AuNPs对细胞辐射敏感性的影响:以表2中0 Gy细胞存活率为基准,定义其相对存活率为100%,对各组的细胞存活率进行校正,从而得到细胞存活率曲线。图1为不同浓度AuNPs@PEG预处理联合X射线照射后HeLa细胞存活率曲线。与单纯照射组(0 mg/L组)比较,不同浓度组的存活率差异有统计学意义(F=5.65、7.90,P < 0.05),表明AuNPs@PEG可以增加HeLa细胞的辐射敏感性。
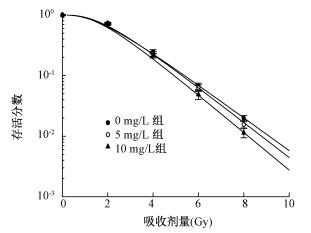
|
注:与 0 mg/L比较,5 mg/L时各剂量点,F=5.65,P < 0.05;10 mg/L时各剂量点,F=7.90,P < 0.05 图 1 AuNPs@ PEG纳米粒子对HeLa细胞辐射敏感性的影响 |
图2为不同浓度AuNPs@PEG-AS1411预处理联合X射线照射后HeLa细胞存活率曲线。与单纯照射组(0 mg/L组)比较,不同浓度组的存活率曲线差异有统计学意义(F=14.97、48.23,P < 0.05),表明AuNPs@PEG-AS1411可以增加HeLa细胞的辐射敏感性。
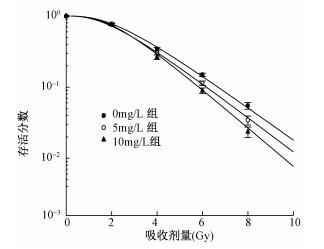
|
注:与 0 mg/L比较,5 mg/L时各剂量点,F=14.97,P < 0.05;10 mg/L时各剂量点,F=48.23,P < 0.05 图 2 AuNPs@ PEG-AS1411纳米粒子对 HeLa细胞辐射敏感性的影响 |
图3为不同浓度AuNPs@PEG-cApt预处理联合X射线照射后对HeLa细胞存活率曲线,从图3可以看出:与单纯照射组(0 mg/L组)比较,不同浓度组的存活率曲线差异有统计学意义(F=5.24、7.51,P < 0.05),表明AuNPs@PEG-cApt可以增加HeLa细胞的辐射敏感性。
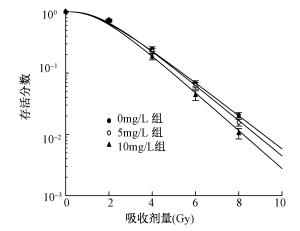
|
注:与 0 mg/L比较,5 mg/L时各剂量点,F=5.24,P < 0.05;10 mg/L时各剂量点,F=7.51,P < 0.05 图 3 AuNPs@ PEG-cApt纳米粒子对 HeLa辐射敏感性的影响 |
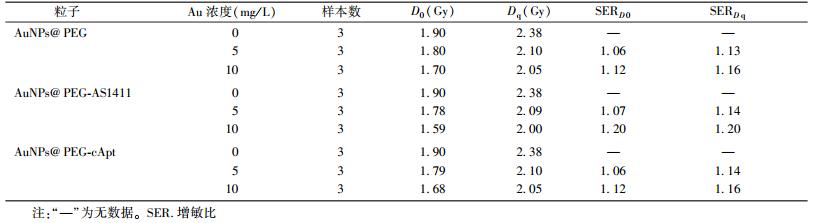
使用单击多靶模型拟合细胞存活曲线,得出的D0、Dq值见表3。结果表明,SERD0、SERDq随着AuNPs@PEG-AS1411浓度的增加而增加,3种纳米粒子都可以增加HeLa细胞的辐射敏感性,增敏比与Au的浓度相关,但在0~10 mg/L范围内,增敏效果还不明显。AuNPs@PEG-AS1411的增敏比最大,AuNPs@PEG和AuNPs@PEG-cApt的增敏比无明显差异,表明AS1411修饰AuNPs可以增强AuNPs的辐射增敏作用。
| 表 3 3种纳米粒子的辐射增敏比 |
已有研究表明,AuNPs有辐射增敏作用,但要求Au浓度要达到500 mg/L,才有明显的增敏作用[2, 4, 5, 6, 7, 8]。如此大量的AuNPs进入人体,存在极大的安全隐患。Cho等[9]研究证实,4.26 mg/kg PEG修饰的13 nm AuNPs在小鼠肝脏中引起明显炎症和凋亡。本研究中,浓度达到10 mg/L时细胞存活率降到约80%,表明AuNPs存在长期毒性。因此,为减少对正常组织的损伤,用AuNPs作增敏剂,需要将AuNPs靶向到肿瘤细胞。Hainfeld等[5]研究表明,AuNPs增敏比与细胞内AuNPs的浓度相关。细胞对AuNPs的吸收与纳米粒子的大小、表面修饰密切相关,增加细胞内金纳米浓度,必须对AuNPs的表面进行修饰,使其更容易进入细胞内[3,10, 11]。Chattoppadhyay等[12]发现,利用Her-2修饰AuNPs,使其靶向到肿瘤细胞和肿瘤组织,发现可以增强辐射效应。而裸AuNPs是胶体,稳定性差,并且纳米粒子进入体内,很容易被肝脏或脾脏中的巨噬细胞吞噬。为了提高AuNPs的稳定性和生物相容性,防止被肝脏或脾脏中的巨噬细胞所清除,最常用的方法用PEG修饰纳米粒子表面[13]。由于PEG的作用,AuNPs@PEG难以进入细胞内,但会吸附在细胞膜上,AuNPs进入细胞的量很少[3]。需要在PEG的末端连接上能够促进纳米粒子进入肿瘤细胞及细胞核的分子,如细胞穿膜肽、能够结合核仁素(necleolin)的适配体AS1411等,使AuNPs靶向肿瘤细胞,容易穿过细胞膜,大量沉积在细胞内[14, 15]。
核仁素是正常细胞核中丰度最高的磷酸化核蛋白,约占核仁蛋白的10%[16]。核仁素具有多种生物功能,包括调控核糖体的生物合成和成熟,调控细胞分化增殖、胞质分裂、染色质复制、核仁发生,抗细胞凋亡等。正常的细胞膜上无核仁素,而对于快速生长细胞、肿瘤细胞,则在细胞质中过表达,并被转运到细胞表面[16, 17]。肿瘤细胞表面的核仁素可作为肿瘤细胞的标志物,也可作为靶向肿瘤细胞的靶点。肿瘤细胞表面的核仁素可以将其配体从细胞表面传送到细胞核中[15]。利用肿瘤细胞表面核仁素的特性,将AuNPs靶向输运到肿瘤细胞中。核酸适配体AS1411是核仁素的特异性适配体,具有体积小、化学性质稳定不易被降解、易于合成、易修饰、无免疫原性等优点[18]。因此,本研究中,选用AS1411修饰AuNPs@PEG,利用肿瘤细胞表面核仁素过表达,而正常细胞表面无核仁素的特点,使AuNPs靶向肿瘤细胞,再利用核仁素的输运特性,将AuNPs输运到肿瘤细胞内。通过制备PEG和PEG-AS1411修饰的AuNPsAuNPs@PEG和AuNPs@PEG-AS1411,研究AuNPs@PEG、AuNPs@PEG-AS1411在HeLa内的沉积,以及AuNPs@PEG、AuNPs@PEG-AS1411对HeLa细胞辐射敏感性的影响,结果表明,AS1411修饰AuNPs可以增加HeLa细胞内AuNPs数量。对于X射线,AS1411可以增强AuNPs@PEG的辐射增敏作用,增敏效果与纳米粒子浓度成正相关,其机制可能与AS411修饰的AuNPs更容易进入到肿瘤细胞有关。Au浓度达到10 mg/L时,增敏比达到1.20,增敏效果不显著。增敏比低的原因是使用的AuNPs浓度比较低,细胞内AuNPs太少。影响肿瘤细胞内AuNPs浓度的因素很复杂,如纳米粒子的粒径、表面修饰等。还需要进行进一步的研究,提高AuNPs的辐射增敏效果。
| [1] | Connor EE, Mwamuka J, Gole A, et al. Gold nanoparticles are taken up by human cells but do not cause acute cytotoxicity[J]. Small, 2005,1(3):325-327. |
| [2] | Jain S, Coulter JA, Hounsell AR, et al. Cell-specific radiosensitization by gold nanoparticles at megavoltage radiation energies[J]. Int J Radiat Oncol Biol Phys, 2011, 79(2):531-539. |
| [3] | Oh E, Delehanty JB, Sapsford KE, et al. Cellular uptake and fate of PEGylated gold nanoparticles is dependent on both cell-penetration peptides and particle size[J]. ACS Nano, 2011,5(8):6434-6448. |
| [4] | Zheng Y, Hunting DJ, Ayotte P, et al. Radiosensitization of DNA by gold nanoparticles irradiated with high-energy electrons[J]. Radiat Res, 2008, 169(1):19-27. |
| [5] | Hainfeld JF, Slatkin DN, Smilowitz HM. The use of gold nanoparticles to enhance radiotherapy in mice[J]. Phys Med Biol, 2004, 49(18):N309-N315. |
| [6] | Misawa M, Takahashi J. Generation of reactive oxygen species induced by gold nanoparticle under X-ray and UV irradiations[J]. Nanomedicine, 2011,7(5):604-614. |
| [7] | Rahman WN, Bishara N, Ackerly T, et al. Enhancement of radiation effects by gold nanoparticles for superficial radiation therapy[J]. Nanomedicine,2009,5(2):136-142. |
| [8] | Tao K, Zeng J, Wang X, et al. Enhancement of radiation cytotoxicity in breast cancer cells by localized attachment of gold nanoparticles[J]. Small, 2008, 4(9):1537-1543. |
| [9] | Cho WS, Cho M, Jeong J, et al. Acute toxicity and pharmacokinetics of 13 nm-sized PEG-coated gold nanoparticles[J]. Toxicol Appl Pharm, 2009,236(1):16-24. |
| [10] | Gu YJ,Cheng J, Lin CC, et al. Nuclear penetration of surface functionalized gold nanoparticles[J]. Toxicol Appl Pharm,2009,237(2):196-204. |
| [11] | Cho EC, Au L, Zhang Q, et al. The effects of size, shape, and surface functional group of gold nanostructures on their adsorption and internalization by cells[J]. Small,2010,6(4):517-522. |
| [12] | Chattopadhyay N, Cai Z, Kwon YL, et al. Molecularly targeted gold nanoparticles enhance the radiation response of breast cancer cells and tumor xenografts to X-radiation[J]. Breast Cancer Res Treat, 2013,137(1):81-91. |
| [13] | Conde J, Ambrosone A, Sanz V, et al. Design of multifunctional gold nanoparticles for in vitro and in vivo gene silencing[J]. ACS Nano,2012,6(9):8316-8324. |
| [14] | Hosta-Rigau L, Olmedo I, Arbiol J, et al. Multifunctionalized gold nanoparticles with peptides targeted to gastrin-raleasing peptide receptor of a tumor cell line[J]. Bioconjugate Chem,2010,21(6):1070-1078. |
| [15] | Dam DHM, Lee JH, Sisco PN, et al. Direct observation of nanoparticle-cancer cell nucleus interactions[J]. ACS Nano,2012,6(4):3318-3326. |
| [16] | Medina FJ, González-Camacho F, Manzano AI, et al. Nucleolin, a major conserved multifunctional nucleolar phosphoprotein of proliferating cells[J]. J Appl Biomed,2010,8(3):141-150. |
| [17] | Berger CM, Gaume X, Bouvet P. The roles of nucleolin subcellular localization in cancer[J]. Biochimie,2015,113(1):78-85. |
| [18] | Bates PJ, Laber DA, Miller DM, et al. Discovery and development of the G-rich oligonucleotide AS1411 as a novel treatment for cancer[J]. Exp Mol Pathol,2009,86(3):151-164. |
 2015, Vol. 35
2015, Vol. 35