放射治疗是肺癌的重要治疗手段之一,但反复受到射线照射的肿瘤细胞容易产生放射抵抗。本研究通过反复照射肿瘤细胞,建立辐射抗拒Lewis肺癌细胞系,观察其肿瘤相关蛋白表达水平及分泌细胞因子水平的变化,一方面为肿瘤放射敏感性的相关研究提供实验材料,另一方面为辐射促进肿瘤抗原的表达提供实验依据。
1. 主要仪器与试剂:直线加速器为瑞典医科达公司Precise 5839型;用于检测TNF-α、IL-12的ELISA试剂盒购于欣博盛生物技术有限公司;CCK-8试剂盒由日本同仁化学研究所生产;Western blot所用试剂及耗材购于南京凯基生物有限公司。Survivin一抗购于美国Cell Signal Technology公司。羊抗兔二抗购于美国Santa Cruz公司。
2. 细胞培养:Lewis肺癌细胞系,购于中国科学院上海生命科学研究院。用含10%胎牛血清的DMEM培养液,置于37℃、5%CO2饱和湿度的培养箱内培养,将细胞传代至指数生长期使用。
3. 细胞照射及一般形态学观察:指数生长期Lewis肺癌细胞系(LLC)细胞,在室温下,用直线加速器6 MV X射线照射,照射野7 cm×7 cm,源靶距100 cm,表面覆1 cm厚组织补偿胶,吸收剂量率200 cGy/min,照射5 Gy后继续常规培养,待细胞达指数生长期末时,消化细胞,将适量细胞接种传代,共传代3次,待细胞再次达到指数生长期时再照射相同剂量。重复以上过程,总共照射6次,获得辐射抵抗细胞系(R-LLC),整个照射及培养过程共约4个月。对反复照射得到放射抗拒细胞系R-LLC细胞常规传代>10代后待用。 显微镜下观察两种细胞单层贴壁后指数生长期的细胞形态学差异。
4. CCK-8实验检测两组细胞增殖情况:在96孔板中配制各100 μl 的LLC和R-LLC细胞悬液(约5 000 个),培养箱预培养24 h。随后将其分别接受 0、2、4、6和8 Gy剂量的照射,24 h后向培养板加入10 μl CCK-8溶液,将培养板在培养箱内孵育 2 h。用酶标仪测定细胞悬液在 450 nm处的吸光度。
5. 克隆扩增实验检测两种细胞存活分数:取对数生长期的LLC和 R-LLC细胞,单次剂量照射分别为 0、2、4、6和8 Gy,随后将细胞用胰酶消化制成单细胞悬液,分别计数后将其接种于60 mm的培养皿中(不同照射剂量、不同细胞/孔)继续培养14 d,镜下观察集落形成后,用4%多聚甲醛固定、亚甲蓝染色。计算集落数(>50个细胞的集落)和细胞接种率(PE,%),并计算细胞存活分数(SF)。PE=各组集落数/接种细胞数×100%; SF=处理组PE/对照组PE。应用 Graphpad prim 5 版软件,单击多靶模型SF=1-(1-eD/D0)N,拟合两组细胞存活曲线,计算两组细胞放射生物学参数 D0(平均致死剂量)、N(外推值)、Dq(准阈剂量)和SF2的值。
6. Western blot检测两种细胞系Survivin蛋白表达: LLC细胞和R-LLC细胞培养至指数生长期后,用冷细胞裂解液[含1[DK]∶100的苯甲基磺酰氟(PMSF)]提取蛋白质,考马斯亮蓝(Bradford)法测定所提取蛋白的含量。每个孔道加入含50 μg的两组细胞的蛋白样品。电泳后,湿转法将凝胶转移到PVDF膜。转膜完成后将膜用5%脱脂奶粉室温封闭2 h。之后加入Survivin一抗(1[DK]∶800稀释),置于摇床上4℃孵育过夜。次日,膜用三乙醇胺缓冲盐水溶液(TBS-T)洗涤3次,每次间隔为15 min,洗膜后加入羊抗兔二抗(1[DK]∶4 000)。最后用德国Millipore公司显影液于上海Tanon化学发光成像系统检测和分析蛋白条带。
7. ELISA法检测两种细胞系培养液上清TNF-α、IL-12的浓度:分别取1×105个处于对数生长期的LLC和R-LLC细胞,接种于6孔板内,待细胞贴壁生长至指数生长期,收集培养液上清,3 724×g离心15 min除去死细胞及细胞碎片,采用酶联免疫吸附法(ELISA)检测TNF-α、IL-12细胞因子浓度水平。操作步骤严格按照试剂盒说明书要求进行。以上实验每个药物浓度设3个平行样,均重复3次。
8. 统计学处理:数据用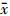 ± s表示。所有实验结果均重复3次以上,用Graphpad prism5、SPSS 20.0软件制图及进行统计分析,两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
± s表示。所有实验结果均重复3次以上,用Graphpad prism5、SPSS 20.0软件制图及进行统计分析,两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
1. 细胞形态: 200倍显微镜下观察指数生长期贴壁细胞,发现R-LLC细胞多梭形,贴壁性好,且易聚集成片生长,细胞之间相连较紧密,LLC细胞则贴壁性较差,故细胞呈多边形、类圆形,细胞间界限较清楚。
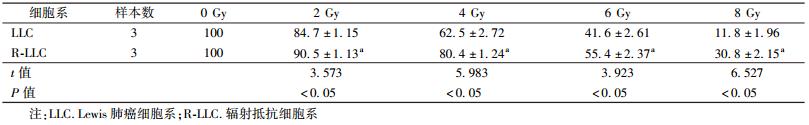
2. 细胞增殖结果:不同剂量(2、4、6和8 Gy)照射后,R-LLC细胞的细胞活力均明显高于 LLC细胞,差异有统计学意义(t=3.573、5.983、3.923、6.527,P < 0.05),见表1。
表 1 两种细胞不同剂量照射后的增殖情况(%,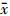 ± s)
Table 1 Comparison of weight calculation algorithms ± s)
Table 1 Comparison of weight calculation algorithms |
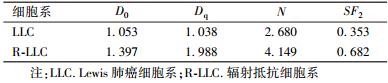
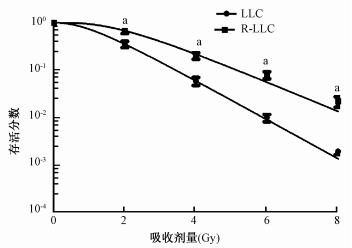
3. 细胞克隆结果: R-LLC细胞起始处肩部增宽,显示了明显的辐射抵抗,在不同放射剂量点处的细胞存活分数与LLC细胞相比,差异有统计学意义(t=4.379、6.615、8.879、6.209,P < 0.05,图1)。其射线平均致死剂量 D0 与 LLC细胞相比分别是(1.397±0.128)和(1.053±0.214)Gy,R-LLC细胞的放射抵抗性约是LLC细胞的1.33倍。两组细胞在不同剂量照射时的存活分数经单击多靶模型拟合后得到的放射生物学参数,见表2。
|
注:LLC. Lewis肺癌细胞系;R-LLC.辐射抵抗细胞系;a与 LLC组比较,t=4.379、6.615、8.879、6.209,P < 0.05 图 1 单击多靶模型拟合LLC、R-LLC 细胞存活曲线 |
| 表 2 LLC和R-LLC细胞的放射生物学参数比较 |
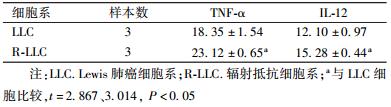
4. 蛋白及细胞因子的表达: 由图2可知,R-LLC细胞Survivin蛋白的表达要明显高于LLC细胞,差异有统计学意义(t=15.310,P < 0.05)。R-LLC细胞产生辐射抗拒性可能还与Survivin蛋白水平的上调有关;如表3所示,LLC细胞培养液上清TNF-α和IL-12浓度分别为(18.35±1.54)ng/ml和(12.10±0.97)ng/ml,R-LLC则分别为(23.12±0.65)ng/ml和(15.28±0.44)ng/ml,两者相比,差异有统计学意义(t=2.867和3.014,P < 0.05)。

|
图 2 LLC细胞与R-LLC细胞Survivin蛋白表达水平的比较 |
表 3 LC细胞与R-LLC细胞分泌细胞因子水平的比较(ng/ml,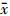 ± s) ± s)
|
肺癌是全球导致癌症相关死亡的首要疾病[1],其发病率逐年攀升,尤其是非小细胞肺癌(NSCLC),约占肺癌总数的75%~80%。约2/3的NSCLC 患者在诊断时已经处于中晚期,失去了最佳手术时机,放射治疗在NSCLC的局部根治性治疗中或晚期姑息治疗中起着重要的作用[2]。然而,放射抗拒是影响放疗疗效的主要生物学因素,是肿瘤治疗的一大障碍,阐明其机制就有可能设计出针对性的治疗方案,以同一来源但放射敏感性不同的一对细胞为对象进行对照研究将有更多的优势。而且本课题组在前期的CpG ODN1826联合X射线放射增敏的实验中发现,肿瘤治愈小鼠再次种植肿瘤细胞后,未见肿瘤生长[3],因此,推测高剂量CpG与多次照射肿瘤协同使小鼠获得了特异性抗肿瘤的能力。研究发现,电离辐射可以上调肿瘤细胞、基质细胞及血管内皮细胞中的主要组织相容性复合体(MHC)类分子、共刺激分子、黏附分子等免疫调节表面分子和分泌型分子如细胞因子、炎症调节因子的表达[4]。放疗能够促进肿瘤相关抗原的表达以及促进新的肿瘤抗原产生,激活抗肿瘤免疫反应[5]。也有研究发现,放疗能够有效促进MHC-Ⅰ类分子的表达,同时促进树突状细胞(DC)成熟并向肿瘤浸润[6]。
Survivin 基因是凋亡抑制蛋白家族(IAPs)的重要成员,其具有独特的分子结构,组织表达呈现特异性。Survivin 具有抑制凋亡、参与细胞周期调控、促进血管生成的功能[7];在多种恶性肿瘤中都高表达,而且对于肿瘤细胞对化疗和放疗的耐受具有增强作用。肿瘤细胞持续表达Survivin可能是引起其对放射线抵抗的一个重要因素[8]。有研究发现,对放射线不敏感的直肠癌细胞系中有高水平的Survivin表达,对放射线敏感的直肠癌细胞系中Survivin的表达水平则很低[9]。
基于以上理论和研究基础,本研究采用X射线多次照射诱导Lewis肺癌细胞,获得放射抗拒细胞系,旨在观察两种细胞系放射生物学的差异及肿瘤相关抗原的变化,包括表面蛋白分子及细胞因子。本实验结果显示,反复辐射后的Lewis肺癌细胞的放射生物学参数揭示了其辐射抗性的产生,而且R-LLC细胞较LLC细胞Survivin表达上调,间接证明了其放疗的抗拒性及放疗促进肿瘤相关抗原的表达;TNF-ɑ及IL-12与肿瘤免疫调节关系密切,能促进T细胞的活化及MHC-I类抗原表达,增强IL-2依赖的胸腺细胞、T细胞增殖能力,促进IL-2、CSF和IFN-γ等淋巴因子的产生,增强有丝分裂原或外来抗原刺激B细胞的增殖和Ig分泌,进而促进对肿瘤细胞的杀伤作用。有研究显示,肿瘤接受放疗后,邻近引流淋巴结内的T细胞增殖活化水平明显高于未放疗者[10],这可能与放疗上调细胞因子的表达有关。本实验中,ELISA法检测这两种细胞系分泌的细胞因子TNF-ɑ和IL-12水平,结果显示,R-LLC细胞系比LLC在同样条件下能分泌更多的细胞因子。不难想象若以R-LLC制备肿瘤全细胞疫苗免疫小鼠,高表达的蛋白水平及细胞因子水平可使小鼠产生的免疫应答反应较LLC细胞疫苗更为强烈。由此可见,本研究通过反复辐射使肿瘤细胞获得了辐射抗性,与此同时,反复辐射又促进了Lewis肺癌细胞肿瘤相关抗原的表达。因此,本研究建立的R-LLC细胞系,可用于肿瘤放疗敏感性的相关研究,而且又从蛋白表达及细胞因子的水平揭示了其较亲本LLC细胞系有更强的肿瘤免疫原性,为肿瘤免疫研究提供了实验基础。
| [1] | Jemal A, Siegel R, Ward E, et al. Cancer statistics,2008[J]. CA Cancer J Clin, 2008,58(2):71-96. |
| [2] | Halasz LM, Weeks JC, Neville BA, et al. Use of stereotactic radiosurgery for brain metastases from non-small cell lung cancer in the United States[J]. Int J Radiat Oncol Biol Phys, 2013,85(2):e109-116. |
| [3] | 庄喜兵,乔田奎,陈伟,等.含非甲基化二核苷酸的寡脱氧核苷酸1826对Lewis肺癌放疗联合作用及其剂量-效应关系[J].中华放射医学与防护杂志,2012,32(3):266-269. |
| [4] | Friedman EJ. Immune modulation by ionizing radiation and its implications for cancer immunotherapy[J]. Curr Pharm Des,2002,8(19):1765-1780. |
| [5] | 于金明, 滕菲菲. 放疗与免疫治疗联合应用的相关机制及研究进展[J]. 中国肿瘤临床, 2014,41(9):547-550. |
| [6] | Zeng J, See AP, Phallen J, et al. Anti-PD-1 blockade and stereotactic radiation produce long-term survival in mice with intracranial gliomas[J]. Int J Radiat Onco Biol Phys,2013,86(2):343-349. |
| [7] | Vaira V, Lee CW, Goel HL, et al. Regulation of survivin expression by IGF-1/m TOR signaling[J]. Oncogene, 2007,26(19):2678-2684. |
| [8] | Ogura A, Watanabe Y, lizuka D, et al. Radiation-induced apoptosis of tumor cells is facilitated by inhibition of the interaction between Survivin and Smac/DIABLO[J]. Cancer Lett,2008,259(1):71-81. |
| [9] | Khanna N, Sen S, Sharma H, et al. S29 ribosomal protein induces apoptosis in H520 cells and sensitizes them to chemotherapy[J]. Biochem Biophys Res Commun,2003,304(1):26-35. |
| [10] | Suzuki Y, Mimura K, Yoshimoto Y,et al. Immunogenic tumor cell death induced by chemoradio-therapy in patients with esophageal squamous cell carcinoma[J]. Cancer Res,2012,72(16):3967-3976. |
 2015, Vol. 35
2015, Vol. 35