2. 清华大学第一附属医院血液肿瘤科;
3. 暨南大学医学院血液病研究所
Burkitt 淋巴瘤是一种高度恶性的非霍奇金淋巴瘤,化疗是其主要治疗方案。但是辅以利妥昔单克隆抗体、手术及局部放疗等辅助治疗措施则可以进一步提高临床治疗效果。局部放疗在Burkitt淋巴瘤治疗中具有一定辅助治疗价值,但是存在并发症,即大剂量辐射对正常组织细胞的损伤。所以,研究Burkitt淋巴瘤放疗敏感性因素对其临床局部放疗具有积极意义。最近,研究发现miR-155在肿瘤细胞中具有抑制细胞凋亡作用,而且其在多种淋巴瘤中高表达,且预后较差[1, 2, 3, 4, 5, 6]。本研究将通过观察miR-155在淋巴瘤Raji细胞辐射抵抗中作用及其机制,为临床Burkitt 淋巴瘤局部放疗研究提供基础依据。
1. 主要试剂和细胞培养:LipofectaminTM2000(美国Invitrogen公司);miR-155-siRNA由上海吉玛公司设计及合成;miRcute miRNA cDNA第一链合成试剂盒、miRcute miRNA 荧光定量检测试剂盒(北京天根生化科技有限公司);CCK-8试剂盒(日本同仁化学研究所);Annexin-V/PI双染试剂盒(上海碧云天生物技术研究所);RPMI 1640培养基、胎牛血清(美国GIBCO公司);Burkitt淋巴瘤细胞系Raji细胞由本实验室保存。 Raji细胞冻存复苏后以含10%胎牛血清、100 U/ml青霉素和100 U/ml链霉素的RPMI 1640培养,置于5%CO2、饱和湿度、37℃孵育箱。
2. CCK-8法检测细胞增殖活性: 实验分空白对照组(CON)、溶媒对照组(MC)、单纯照射组(IC)、siRNA组(siRNA,浓度0.01、0.1、1.0和10.0 μmol/L)和siRNA+照射组(sIC,siRNA浓度1.0 μmol/L)。siRNA转染根据LipofectamineTM 2000试剂盒操作说明进行;IC和sIC组细胞采用德国Simens Primart电子直线加速器产生的6 MeV X射线照射细胞(在25 cm2培养瓶中处理后加入相应组),剂量率为 1.53 Gy/min,放射源至细胞的距离为100 cm,照射野为25 cm×25 cm,总剂量为4.0 Gy,参考文献[7]。取对数生长期细胞200 μl接种于96孔板中(密度2×104/ml),置于5%CO2、饱和湿度、37℃孵育箱中培养,48 h时进行CCK-8检测,计算增殖抑制率。增殖抑制率(%)=(1-siRNA组A450/溶媒对照组A450)×100%,实验重复3次。
3. 实时定量聚合酶链反应(RQ- PCR)检测目标基因表达:取对数生长期细胞以5×104 /ml密度接种于6孔板中,每孔2 000 μl,以1.0 μmol/L siRNA转染干预,24 h后,收集细胞,使用miRcute miRNA分离试剂盒提取miRNA,经纯度及电泳检测后,根据miRcute miRNA cDNA第一链合成试剂盒操作说明合成cDNA第一链,采用实时荧光定量PCR 法检测miR-155 RNA表达,以GAPDH为内参,采用2-△△ CT法计算miR-155相对表达量。GAPDH上游引物为5' GGATTTGGTCGTATTGGG 3';下游引物为5' GTGGCTGGGGCTCTACTTC 3';miR-155 RNA上游引物为5' GCGGTTAATGCTAATCGTGAT 3';下游引物为5' GTGCAGGGTCCGAGGT 3'; PTEN 上游引物为 5' GCTATGGGATTTCCTGCAGAA 3',下游引物为5' GGCGGTGTCATAATGTCTTTCA 3'。
4. Annexin V-PI 双染检测细胞凋亡:收集处理48 h后细胞,加入195 μl Annexin V-FITC结合液重悬细胞,加入5 μl Annexin V-FITC室温避光孵育10 min,离心(500× g,5 min)弃上清,加Annexin V-FITC结合液190 μl重悬细胞,加PI染色液10 μl避光冰浴,流式细胞仪检测。
5. Western blot检测: miR-155 siRNA处理48 h后,收集细胞、PBS洗2遍,加蛋白抽提液提取总蛋白,测定蛋白浓度,10% SDS-PAGE电泳及转PVDF膜,5%脱脂奶粉封闭1 h。PTEN、GAPDH及p-AKT抗体 4℃过夜,HRP标记二抗室温孵育1 h,以TBST洗3次,ECL显色液发光、成像。
6. 统计学处理:采用SPSS 13.0统计软件进行数据处理,实验数据中计量资料以 ± s表示,多组间数据各组间比较采用单因素方差分析(one-way ANOVA),组间的比较采用SNK或Tukey检验。P < 0.05为差异有统计学意义。
± s表示,多组间数据各组间比较采用单因素方差分析(one-way ANOVA),组间的比较采用SNK或Tukey检验。P < 0.05为差异有统计学意义。
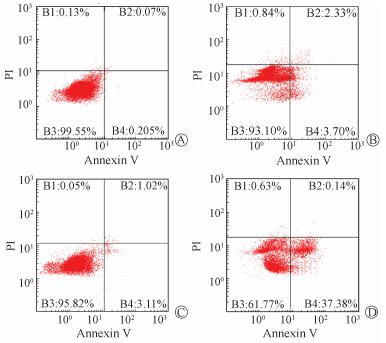
1. miR-155 siRNA 对Raji细胞增殖及其辐射敏感性的影响:CCK-8结果显示,miR-155 siRNA在0.01 μmol/L时作用不明显,0.1~10.0 μmol/L处理Raji细胞48 h后,细胞的增殖均受到抑制,但各浓度之间比较,差异无统计学意义(P>0.05)。流式细胞术结果显示,4.0 Gy X射线照射后48 h,单纯照射组Raji细胞凋亡率为(6.24±0.93 )%,1.0 μmol/L miR-155 siRNA处理组细胞凋亡率为(5.69±0.94 )%,而siRNA+射线照射组细胞凋亡率为(36.78±1.35 )%,高于单纯照射组,差异有统计学意义(t=12.572,P < 0.01),见图1。
|
图 1 miR-155siRNA与4.0 Gy辐射对Raji细胞凋亡的影响 Annexin V-PI 双染检测细胞凋亡的流式细胞散点图:B1为机械损伤细胞部分,B2为晚期凋亡细胞部分,B3为正常细胞,B4为早期凋亡部分。 A.空白对照组;B.单纯照射组;C.1.0 μmol/L miR-155 siRNA处理组;D.1.0 μmol/L miR-155 siRNA+射线照射组 |
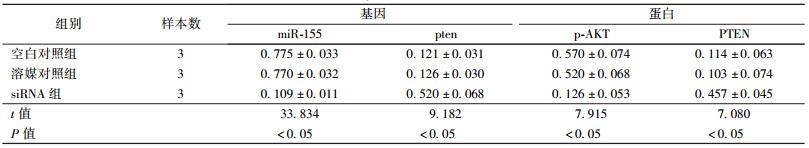
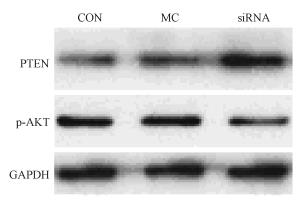
2. miR-155 siRNA 对Raji细胞中PTEN和AKT表达水平的影响:qRT-PCR检测显示(表1),正常培养的Raji细胞表达有miR-155 mRNA,其表达量与GAPDH mRNA量比值为(0.775±0.033),pten mRNA表达水平较低,其表达量与GAPDH mRNA量比值为(0.121±0.031);Western blot检测显示(图2),Raji细胞中PTEN表达水平较低、而p-AKT表达水平较高。miR-155 siRNA处理不仅使miR-155 mRNA表达水平显著下降(t=33.834,P < 0.05),而且出现pten mRNA(t=9.182,P < 0.05)和蛋白升高(t=7.080,P < 0.05),p-AKT表达水平下降,与溶媒对照组相比,差异有统计学意义(t=7.915,P < 0.05)。
| 表 1 siRNA处理Raji细胞前后基因和蛋白表达变化 |
|
图 2 miR-155 siRNA 对Raji细胞中PTEN和p-AKT表达水平的影响 CON.空白对照组;MC.溶媒对照组;siRNA.miR-155 siRNA处理组 |
越来越多的研究发现,miRNA异常表达可改变淋巴细胞生长发育、存活与凋亡命运,从而导致淋巴瘤发生发展[8, 9, 10],而且与肿瘤细胞放化疗敏感性具有密切关系[11, 12]。miR-155是21号染色体上B细胞整合簇(BIC)基因上的非编码RNA转录产物,正常情况下具有促进淋巴细胞发育分化作用,异常高表达则直接或间接地降低具有促进凋亡功能蛋白的合成。研究发现,miR-155在一些B细胞淋巴瘤,包括小儿Burkitt淋巴瘤、弥漫大B细胞性淋巴瘤、原发纵隔B细胞淋巴瘤和霍奇金病(HL)中异常高表达,而且miR-155高表达的活化B细胞型弥漫大B细胞性淋巴瘤(DLBCL)预后比低表达的生发中心型DLBCL的较差[13, 14]。Yamanaka等[15]研究发现,高表达miR-155可导致自然杀伤细胞淋巴瘤pten等表达水平下降、AKT(ser473)高磷酸化,抑制miR-155表达则pten等表达水平升高,AKT(ser473)磷酸化下调。pten基因是一种极其重要的肿瘤抑制基因,PTEN蛋白是肿瘤抑制因子蛋白,具有脂质和蛋白双重磷酸酶活性,在细胞生长、生存与凋亡等方面发挥重要作用。在正常情况中,pten则可利用磷酸酶活性使PIP3脱磷酸形成丧失信使功能的PIP2,从而抑制PI3K/AKT信号通路。相反,pten表达下调、突变或缺失,则细胞内PIP3积聚、AKT持续活化,从而抑制细胞凋亡,促进细胞生长,导致肿瘤的发生发展。研究表明 PTEN/ PI3K/AKT 信号通路广泛存在于各种肿瘤细胞中,促进细胞周期进展,与肿瘤细胞的增殖与凋亡、侵袭转移及耐药等密切相关[16, 17]。
本研究通过应用miR-155 siRNA和辐射单独及联合作用于Burkitt淋巴瘤Raji细胞,观察miR-155 siRNA能否增强辐射对Raji细胞的增殖凋亡作用。研究结果显示,miR-155 siRNA不仅抑制Raji细胞的miR-155表达、影响PTEN/PI3K/AKT信号通路Akt磷酸化,而且抑制细胞增殖、并显著增强辐射诱导的凋亡作用。本研究结果不仅表明miR-155 表达对Raji细胞中PTEN和AKT表达水平具有重要影响,而且证实,miR-155 表达对Raji细胞辐射敏感性具有重要影响。其机制与PTEN/PI3K/AKT信号途径激活有关。该结果对临床Burkitt 淋巴瘤放疗具有积极意义。
| [1] | Huang X, Shen YL, Liu M, et al. Quantitative proteomics reveals that miR-155 regulates the PI3K-AKT pathway in diffuse large B-cell lymphoma[J]. Am J Pathol,2012,181(1):26-33. |
| [2] | Rai D, Kim SW, McKeller MR, et al. Targeting of SMAD5 links microRNA-155 to the TGF-β pathway and lymphomagenesis[J]. Proc Natl Acad Sci USA,2010,107(7):3111-3116. |
| [3] | Dagan LN, Jiang X, Bhatt S, et al. miR-155 regulates HGAL expression and increases lymphoma cell motility[J]. Blood,2012,119(2):513-520. |
| [4] | Kopp KL, Ralfkiaer U, Gjerdrum LM, et al. STAT5-mediated expression of oncogenic miR-155 in cutaneous T-cell lymphoma[J]. Cell Cycle,2013,12(12):1939-1947. |
| [5] | Pouliot LM, Chen YC, Bai J, et al. Cisplatin sensitivity mediated by WEE1 and CHK1 is mediated by miR-155 and the miR-15 family[J]. Cancer Res,2012,72(22):5945-5955. |
| [6] | Liu C, Iqbal J, Teruya-Feldstein J, et al. MicroRNA expression profiling identifies molecular signatures associated with anaplastic large cell lymphoma[J]. Blood, 2013,122(12):2083-2092. |
| [7] | 闵凤玲,刘芬菊,文万信,等. 美罗华通过ROS增加Raji细胞对X射线的辐射敏感性[J]. 中国辐射卫生,2009,18(2):167-170. |
| [8] | Musilova K, Mraz M. MicroRNAs in B-cell lymphomas:how a complex biology gets more complex[J]. Leukemia,2015,29(5):1004-1017. |
| [9] | Tagawa H, Ikeda S, Sawada K. Role of microRNA in the pathogenesis of malignant lymphoma[J]. Cancer Sci, 2013,104(7):801-809. |
| [10] | Sandhu SK, Croce CM, Garzon R. Micro-RNA expression and function in lymphomas[J].Adv Hemato,2011,2011:347137. |
| [11] | Zhang P, Wang L, Rodriguez-Aguayo C, et al. miR-205 acts as a tumour radiosensitizer by targeting ZEB1 and Ubc13[J]. Nat Commun, 2014,5:5671. |
| [12] | Tan G, Shi Y, Wu ZH. MicroRNA-22 promotes cell survival upon UV radiation by repressing PTEN[J]. Biochem Biophys Res Commun, 2012,417(1):546-651. |
| [13] | Huang X, Shen Y, Liu M, et al. Quantitative proteomics reveals that miR-155 regulates the PI3K-AKT pathway in diffuse large B-cell lymphoma[J]. Am J Pathol,2012,181(1):26-33. |
| [14] | Dagan LN, Jiang X, Bhatt S, et al. miR-155 regulates HGAL expression and increases lymphoma cell motility[J]. Blood, 2012,119(2):513-520. |
| [15] | Yamanaka Y, Tagawa H, Takahashi N, et al. Aberrant overexpression of microRNAs activate AKT signaling via down-regulation of tumor suppressors in natural killer-cell lymphoma/leukemia[J]. Blood,2009,114(15):3265-3275. |
| [16] | Kim RJ, Bae E, Hong YK, et al. PTEN loss-mediated Akt activation increases the properties of cancer stem-like cell populations in prostate cancer[J]. Oncology, 2014,87(5):270-279. |
| [17] | Papa A, Wan L, Bonora M, et al. Cancer-associated PTEN mutants act in a dominant-negative manner to suppress PTEN protein function[J]. Cell, 2014,157(3):595-610. |
 2015, Vol. 35
2015, Vol. 35