近年来调强放疗对肿瘤的治疗发挥了非常重要的作用,尤其是头颈部肿瘤如鼻咽癌,不仅明显降低了并发症的发生率和程度,也使局部控制率和生存率有了极大的提高[1]。但是,以放疗为根治性治疗手段的宫颈癌,调强放疗的作用似乎不大。其原因是盆腔肿瘤较头颈部肿瘤的形变、位移大,调强放疗为了保护正常器官,照射范围明显减小,轻微位移就有可能造成部分靶区漏照,从而影响肿瘤控制率。且治疗不良反应大。本研究利用螺旋断层放疗系统(TOMO)提供的兆伏级CT(MVCT)扫描系统,计算患者单次的受照射剂量,为宫颈癌调强放疗提供临床依据。
1. 病例选择:选取2013年8月至2014年2月于北京军区总医院放疗科行TOMO放疗的宫颈癌患者5例,年龄37~62岁,中位年龄49岁,鳞癌4例,腺癌1例,按照国际妇产科协会(FIGO)2014年分期标准[2],Ⅱb期3例,Ⅲb2例。本研究经北京军区总医院伦理委员会讨论批准,患者均签署知情同意书。
2. CT定位:采用荷兰Philips公司生产的BrillianceTM 大孔径CT进行体位固定和CT扫描。定位前1 h,排空直肠、膀胱,饮水600 ml(含造影碘化剂10 ml),患者仰卧位于体架上,热塑体膜固定,采用CT模拟定位,扫描范围从腰1椎体上缘到耻骨联合下10 cm水平,矩阵512×512,层厚5 mm,行平扫及增强CT扫描。将两套CT定位图像传至荷兰Philips公司的Pinnacle 9.2系统,以增强图像为参考,在平扫图像上勾画靶区。
3. 靶区与危及器官(OAR)勾画:参考文献[3, 4]定义靶区,肿瘤靶区(GTV)包括原发灶(GTVnx)和转移淋巴结(GTVnd),PGTVnd为GTVnd外扩5 mm,CTV包括GTV外扩5 mm、宫颈、子宫、宫旁、部分阴道、盆腔淋巴引流区,CTV上、下外扩10 mm,余方向均匀外扩5 mm为计划靶区(PTV)。
4. 外放疗剂量及OAR限量:95%PTV处方剂量为50 Gy/25次或50.4 Gy/28次,其中有1例淋巴结转移者95%的PGTVnd同步加量至60.2 Gy。OAR限量,膀胱V45<50%,直肠V45<50%,小肠V30<40%、V20<50%、D2 cm3<54 Gy,结肠V50<10%,股骨头V45<5%,骨盆V50<10%、V30<50%,脊髓Dmax<45 Gy。
5. 计划设计和验证:采用美国TOMO公司提供的Tomotherapy 4.1.2.2计划工作站进行计划设计,由副主任以上医师签字确认,在第三方验证系统,瑞典ScandiDos公司生产的Delta4PT通过后开始治疗。
6. 治疗实施和MVCT的获取:治疗前1 h患者排空直肠、膀胱,饮水600 ml。通过TOMO治疗机上搭载的MVCT X射线源和对侧的CT探测阵列,对分次治疗前患者MVCT图像进行采集。每次扫描范围内组织受照射剂量为1~2 cGy,实际测量值为1.2 cGy。所有患者每次治疗前均行MVCT扫描并配准后治疗。其中治疗开始后,每周一、三的MVCT图像扫描范围包括靶区上下2 cm(加长扫描),其余分次的MVCT扫描范围仅包括宫颈或阴道残端所在层面附近。扫描得到的MVCT图像重建后与定位的千伏级CT(kVCT)图像进行基于灰度的自动配准和手动配准,将配准值应用至治疗床,以校正摆位误差。
7. 单次受照射剂量的计算:使用TOMO计划工作站的自适应模块,以初始治疗计划的Sinogram(治疗床的位置、机架角度与每个MLC打开时间的关系)在每幅MVCT图像上重新计算剂量分布,得到当次患者治疗的实际照射剂量[5]。
8. MVCT上靶区勾画:将kVCT图像及勾画的结构、剂量分布矩阵以及MVCT图像、剂量分布矩阵传输至美国MIM软件公司提供的MIM 6.0系统Mimvista图像融合软件,MVCT与定位时的kVCT配准,得到形变矩阵,通过此形变矩阵将计划的靶区及OAR自动勾画到MVCT上,由勾画靶区的医师手动修改,使之适应当前解剖结构,并获得各器官质心的空间位置。所有患者按计划完成MVCT扫描和治疗,共分析5个kVCT序列和加长扫描的50个MVCT序列。
9. 统计学处理:数据以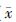 ±s表示。采用SPSS 13.0软件进行数据分析。对宫颈肿物、子宫、CTV质心位移变化比较采用配对t检验、方差分析或Wilcoxon符号秩检验、Friedman M检验。P<0.05为差异有统计学意义。
±s表示。采用SPSS 13.0软件进行数据分析。对宫颈肿物、子宫、CTV质心位移变化比较采用配对t检验、方差分析或Wilcoxon符号秩检验、Friedman M检验。P<0.05为差异有统计学意义。
1. 宫颈肿物退缩与位置变化:5例患者在外放疗结束时宫颈肿物均发生较大程度的退缩,体积由治疗前的(43.64±18.58)cm3下降为治疗后的(13.57±8.31)cm3,平均下降68.90%(t=5.21,P<0.05);最大径由治疗前的(6.02±1.03)cm下降为治疗后的(4.4±0.86)cm,平均降低26.91%(t=8.39,P<0.05)。
2. 宫颈、子宫的位移与体积变化:调强放疗分次间宫颈、子宫的位移与体积变化如图1所示。肿瘤质心左右、前后、头脚方向位移分别为-1.43 mm(-6.21~3.92 mm)、-7.72 mm(-18.07~-0.13 mm)、0.02 mm(-10.63~3.03 mm)。向前方向的位移与左右、头脚方向相比,差异有统计学意义(Z=-5.85、-5.66,P<0.05)。子宫质心左右、前后、头脚方向位移分别为0.40 mm(-6.66~3.30 mm)、-1.24 mm(-14.18~12.44 mm)、-6.51 mm(-48.23~1.34 mm),头脚方向位移>前后、左右方向(Z=-2.81、-5.91,P<0.05),前后方向位移>左右方向(Z=-3.07,P<0.05)。
|
图1 患者调强放疗分次间宫颈、子宫的位移与体积变化 注:红色.治疗前宫颈;黄色.分次治疗间宫颈;橘红色.治疗前子宫;绿色.分次治疗间子宫 |
3. CTV体积与位置变化:放疗前、后CTV体积分别为(776.55±138.87)cm3、(763.62±136.19)cm3,[JP]差异无统计学意义。CTV质心左右、前后、头脚方向位移分别为-0.43 mm(-4.18~3.50 mm)、-1.68 mm(-5.19~1.90 mm)、-0.22 mm(-5.00~3.62 mm),前后方向位移>左右、头脚方向(Z=-4.22、-3.56,P<0.05)。
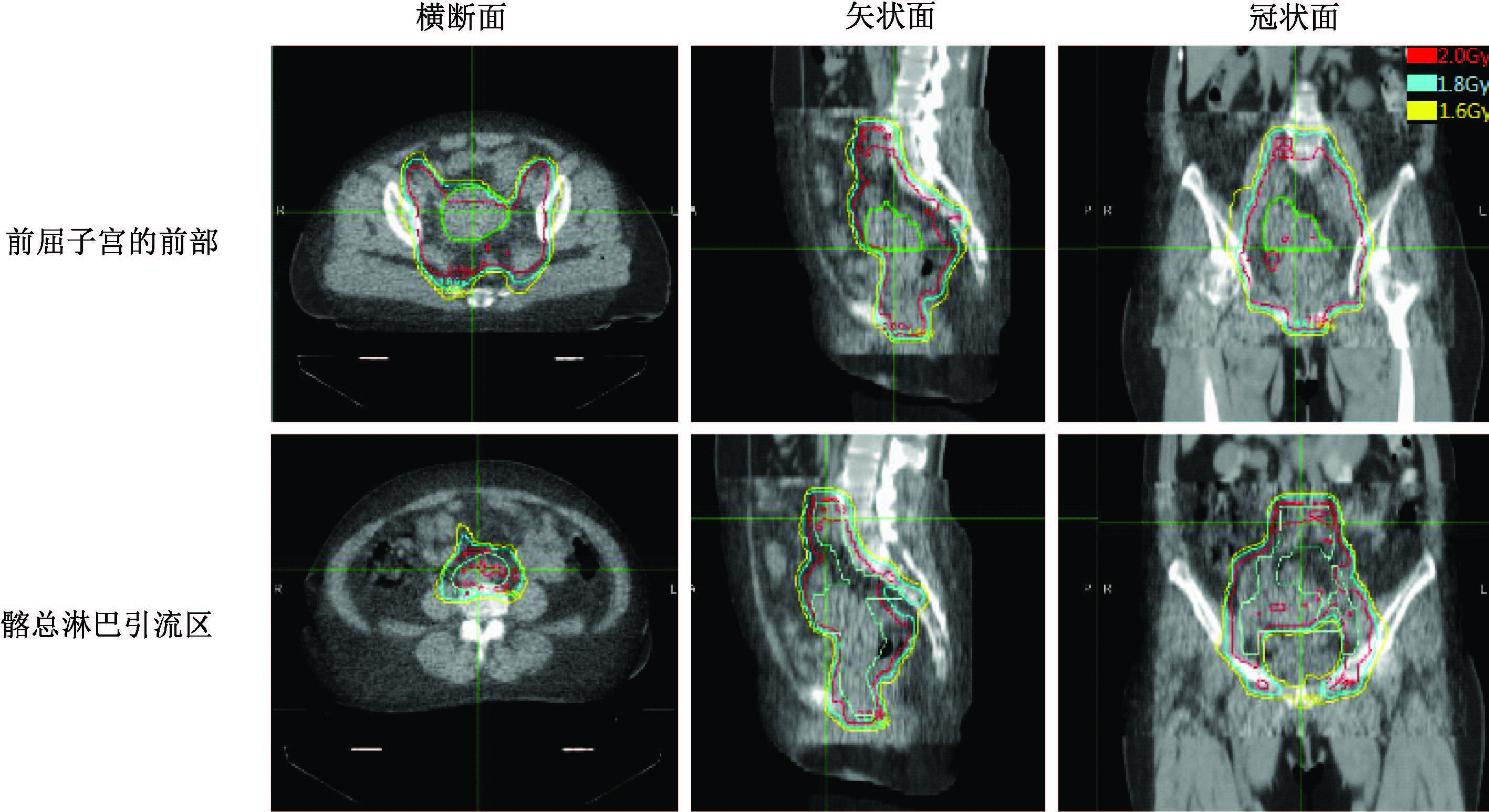
4. 靶区剂量变化:CTV V95%及CTV接受低于95%处方剂量照射的体积结果列于表1。由表1可知,5例患者的50个分次中,GTV均接受95%以上的剂量照射。78%(39/50)的分次中,CTV接受不足95%处方剂量的照射,中位V95%为99.40%(95.96%~100%),中位漏照体积为6.94 cm3(0~32.30 cm3)。其中46%(23/50)分次的子宫接受不足95%处方剂量的照射,中位V95%为100%(78.58%~100%),中位漏照体积为0 cm3(0~6.69 cm3)。患者4第5次治疗期间剂量分布情况如图2所示。靶区漏照主要集中于前屈子宫的前部和髂总淋巴引流区。
| 表1 CTV V95%及CTV接受低于95%处方剂量照射的体积 |
|
图2 患者4 第5 次治疗期间靶区剂量分布 |
调强放疗具有更好的适形性和理想的剂量分布,但因剂量跌落梯度的陡峭,使得微小的位移即可造成靶区漏照和OAR超量,因此,治疗实施的精确性显得尤为重要。对于宫颈癌患者,其肿瘤缩小、生理运动、摆位误差等原因均可造成肿瘤及邻近组织器官发生移动与变化,从而导致实际受照剂量与计划剂量的差异。本研究分析宫颈癌患者治疗期间肿瘤位移及体积变化规律,获得实际受照剂量,从而为临床提供参考。
宫颈鳞癌对放射线敏感,MRI观察宫颈肿物在放疗过程中缩小2%~79%[6]。van de Bunt等[7]观察到仅放疗30 Gy,宫颈肿物体积缩小即可达79%。另有研究发现,同步放化疗21 d后,宫颈肿物直径缩小可达50%[8]。Beadle等[9]发现放疗前、后宫颈平均体积由97缩至31.9 cm3,降低了62.3%。本研究中,肿瘤体积、最大径分别降低了68.90%、26.91%,与上述文献报道相近。
由于肿瘤退缩导致的宫颈及子宫位置的变化,引起一系列周围组织器官变化,导致实际受照剂量与计划剂量出现差异。多项研究发现,放疗分次间与分次内的宫颈位置变化,向左右方向位移较小,前后、头脚方向位移较大,因而前后、头脚方向可能造成靶区的漏照[10, 11, 12]。本研究也取得了基本一致的结果,提示PTV在前后、头脚方向上的外扩应较左右方向为大。Collen等[12]认为若使分次治疗时靶区覆盖率达95%,宫颈需向前、后、左、右、头、脚方向分别外扩17、12、9、8、15、9 mm,而子宫则需分别外扩19、19、13、13、20、19 mm。但是靶区外扩范围的增大必会引起邻近正常器官受照剂量的提高,降低调强放疗的优势。Khan等[13]为降低邻近器官的照射,缩小靶区体积,在靶区不同层面分析了最小外扩范围,CTV向上、左、右外扩1~3 mm,膀胱、直肠层面外扩5~10 mm,子宫层面外扩10~14 mm亦可使CTV覆盖率达95%,同时使计划靶区体积降低了30.33%,但具体疗效如何尚未见报道。
由于计划边缘剂量的存在及治疗分次间的器官运动对实际剂量分布的影响,靶区覆盖情况并不能代表靶区实际受量。Lim等[14]利用离线MRI模拟评估了20例患者的靶区剂量,于MRI上勾画GTV(宫颈肿物)、PCTV(GTV外扩7 mm并包括宫旁组织、宫颈、部分子宫),PTV(PCTV外扩5 mm),利用软件模拟得到所有患者的GTV均接受95%处方剂量以上的照射,仅有1例CTV接受不足95%处方剂量的照射。本研究采取CTV上下外扩10 mm、余方向均匀外扩5 mm形成PTV,利用MVCT在线评估了患者实际照射中的靶区剂量。5例患者的GTV均接受95%处方剂量以上的照射。而子宫由于位于盆腔中部,其位置随膀胱与直肠的充盈程度或体位发生变化,位移明显大于宫颈[15],46%(23/50)分次的子宫接受不足95%处方剂量的照射,V95%低于95%的分次有3次,且都发生在1例子宫前后位移明显患者的分次治疗中。78%(39/50)的分次中CTV接受不足95%处方剂量的照射,中位漏照体积为6.94 cm3(0~32.3 cm3)。尽管本研究在头脚方向上的外扩比Lim等[14]扩大了5 mm,但CTV漏照发生率仍较大,其原因可能是:本研究定义的CTV不仅包括Lim等[14]研究中的pCTV,还包括盆腔淋巴引流区,更能说明靶区总的受照情况;每周在同一固定装置下在线行两次MVCT扫描并获得受照剂量,重复性高,比以原始计划带入每周离线MRI获得的剂量更能代表实际治疗情况。
通过观察剂量分布情况发现,主要漏照区域位于前屈子宫的前部及髂总淋巴引流区。尽管本组患者都采取排空膀胱后饮水600 ml和1 h后治疗的相同条件,但发现多数患者分次治疗间膀胱充盈不好,体积较小,子宫前移明显,也是造成前部漏照的重要原因。盆腔淋巴引流区与骨盆关系相对较固定,图像引导放疗(IGRT)配准时根据宫颈肿物校正误差,可能会造成髂总等较上部位引流区的低量。本研究中尽管有78%分次的CTV发生了漏照,但V95%均>95%,漏照体积并不大,且主要发生于子宫前部、髂总上部等复发可能较低的区域[16],但是采用的这种较小外扩方式是否能够满足临床的要求,还需进一步疗效、生存的随访观察。值得一提的是,所有患者全部分次治疗均行MVCT校正的剂量变化,若无IGRT引导条件下,其外扩是否能满足治疗要求,还有待研究。
有学者认为,对于根治性放疗的宫颈癌患者,随着宫颈肿物的较快退缩,CTV亦发生缩小[16, 17, 18]。本研究于每周两次的MVCT图像上重新勾画CTV,尽管GTV在逐渐缩小,但CTV并无明显变化,与Han等[19]的结果一致。这可能是由于CTV体积除受宫颈肿物退缩的影响外,还与邻近器官体积与位移变化等诸多因素相关。且CTV定义包括GTV外扩0.5 cm、宫颈、子宫、宫旁、部分阴道、盆腔淋巴引流区,宫旁组织前界勾画以膀胱后界作为重要参考标志,随着放疗进行,放射性膀胱炎发生率升高,膀胱充盈欠佳,可能会使靶区前界的勾画进一步前移,CTV体积无明显改变。且在放疗过程中,即使肿瘤组织肉眼消退后,其宫旁组织仍可能存在少量残存肿瘤细胞即亚临床病灶,应给予一定量的照射,因而治疗期间包括宫旁组织的CTV勾画以膀胱后界作为参考标志可能较为合理。
总之,宫颈癌放疗中,肿瘤变化、位置的移动与生理运动等因素的影响,使靶区实际受照剂量与初始计划存在差异,在IGRT基础上,采取靶区上下外扩10 mm、余方向均匀外扩5 mm的标准,将有部分靶区漏照,但漏照体积较小。这种照射方式是否能够满足临床的要求,还需疗效、生存的随访观察。
| [1] | Lai SZ, Li WF, Chen L, et al. How does intensity-modulated radiotherapy versus conventional two-dimensional radiotherapy influence the treatment results in nasopharyngeal carcinoma patients?[J]. Int J Radiat Oncol Biol Phys, 2011, 80(3): 661-668. |
| [2] | International Federation of Gynecology and Obstetrics Committee on Gynecologic Oncology. FIGO staging for carcinoma of the vulva, cervix, and corpus uter[J]. Int J Gynaecol Obstet, 2014, 125(2): 97-98. |
| [3] | Lim K, Small W Jr, Portelance L, et al. Consensus guidelines for delineation of clinical target volume for intensity-modulated pelvic radiotherapy for the definitive treatment of cervix cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 79(2): 348-355. |
| [4] | Toita T, Ohno T, Kaneyasu Y, et al. A consensus-based guideline defining clinical target volume for primary disease in external beam radiotherapy for intact uterine cervical cancer[J]. Jpn J Clin Oncol, 2011, 41(9): 1119-1126. |
| [5] | Shah AP, Langen KM, Ruchala KJ, et al. Patient dose from megavoltage computed tomography imaging[J]. Int J Radiat Oncol Biol Phys, 2008, 70(5): 1579-1587. |
| [6] | Lim K, Chan P, Dinniwell R, et al. Cervical cancer regression measured using weekly magnetic resonance imaging during fractionated radiotherapy: radiobiologic modeling and correlation with tumor hypoxia[J]. Int J Radiat Oncol Biol Phys, 2008, 70(1): 126-133. |
| [7] | van de Bunt L, van der Heide UA, Ketelaars M, et al. Conventional, conformal, and intensity-modulated radiation therapy treatment planning of external beam radiotherapy for cervical cancer: The impact of tumor regression[J]. Int J Radiat Oncol Biol Phys, 2006, 64(1): 189-196. |
| [8] | Lee CM, Shrieve DC, Gaffney DK. Rapid involution and mobility of carcinoma of the cervix[J]. Int J Radiat Oncol Biol Phys, 2004, 58(2): 625-630. |
| [9] | Beadle BM, Jhingran A, Salehpour M, et al. Cervix regression and motion during the course of external beam chemoradiation for cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 73(1): 235-241. |
| [10] | Haripotepornkul NH, Nath SK, Scanderbeg D, et al. Evaluation of intra- and inter-fraction movement of the cervix during intensity modulated radiation therapy[J]. Radiother Oncol, 2011, 98(3): 347-351. |
| [11] | Jadon R, Pembroke CA, Hanna CL, et al. A systematic review of organ motion and image-guided strategies in external beam radiotherapy for cervical cancer[J]. Clin Oncol, 2014, 26(4): 185-196. |
| [12] | Collen C, Engels B, Duchateau M, et al. Volumetric imaging by megavoltage computed tomography for assessment of internal organ motion during radiotherapy for cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2010, 77(5):1590-1595. |
| [13] | Khan A, Jensen LG, Sun S, et al. Optimized planning target volume for intact cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 83(5): 1500-1505. |
| [14] | Lim K, Kelly V, Stewart J, et al. Pelvic radiotherapy for cancer of the cervix: is what you plan actually what you deliver? [J]. Int J Radiat Oncol Biol Phys, 2009, 74(1): 304-312. |
| [15] | Chan P, Dinniwell R, Haider MA, et al. Inter- and intrafractional tumor and organ movement in patients with cervical cancer undergoing radiotherapy: a cinematic-MRI point-of-interest study[J]. Int J Radiat Oncol Biol Phys, 2008, 70(5): 1507-1515. |
| [16] | Kasamatsu T, Onda T, Yamada T, et al. Clinical aspects and prognosis of pelvic recurrence of cervical carcinoma[J]. Int J Gynaecol Obstet, 2005, 89(1): 39-44. |
| [17] | van de Bunt L, Jürgenliemk-Schulz IM, de Kort GA, et al. Motion and deformation of the target volumes during IMRT for cervical cancer: what margins do we need? [J]. Radiother Oncol, 2008, 88(2): 233-240. |
| [18] | Tyagi N, Lewis JH, Yashar CM, et al. Daily online cone beam computed tomography to assess interfractional motion in patients with intact cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 80(1): 273-280. |
| [19] | Han Y, Shin EH, Huh SJ, et al. Interfractional dose variation during intensity-modulated radiation therapy for cervical cancer assessed by weekly CT evaluation[J]. Int J Radiat Oncol Biol Phys, 2006, 65(2): 617-623. |
 2015, Vol. 35
2015, Vol. 35