放射治疗是鼻咽癌主要的治疗手段。近年来调强适形放疗(IMRT)技术广泛应用于临床,IMRT使剂量分布更加适形于靶区,对正常器官有更好的保护作用,在一定程度上减轻了患者放疗后的口干症状,但仍有40%的患者放疗后为口腔干燥所困扰[1]。腮腺和下颌下腺解剖上邻近鼻咽部,鼻咽癌放疗时主要的唾液腺几乎均在照射野之内,因此,放射性口干症在鼻咽癌放疗患者的并发症中最为常见[2, 3]。减少涎腺的照射是减少放射性口干的根本解决方法。涎腺的剂量-效应关系已有较多研究,而腮腺及下颌下腺的剂量限定尚存争议。本研究通过分析双侧涎腺剂量-体积的变化,进一步探究涎腺照射剂量与急性放射性口干的关系,从而为临床实践提供参考。
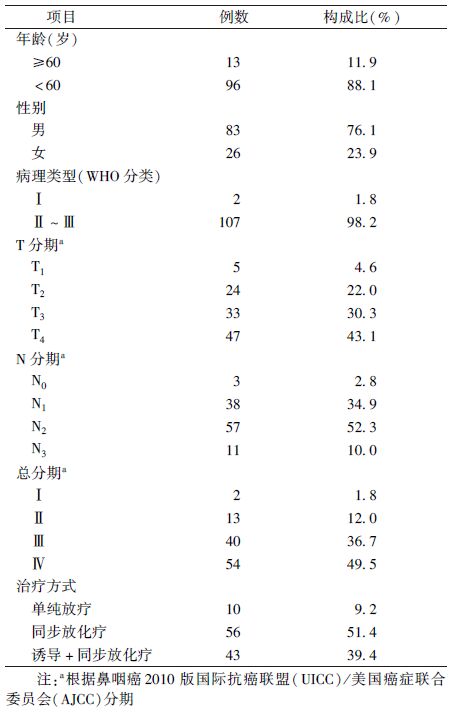
1. 临床资料:收集2013年12月至2014年7月在广西医科大学附属肿瘤医院接受IMRT的初治鼻咽癌患者。入组标准:病理确诊为鼻咽癌的初治患者;无远处转移;年龄18~75岁;KPS评分≥70分;既往无唾液腺疾病且治疗前2个月内未服用抗胆碱药等可能影响唾液腺功能的药物;肝、肾功能等基本正常;接受全程调强适形放射治疗。排除标准:患有其他肿瘤;患有严重的感染或其他合并疾病,并排除精神、心血管、消化、泌尿、血液、内分泌系统等严重原发病;怀孕或哺乳期;曾接受过放疗或化疗;因病情变化不能完成治疗的患者;腮腺受肿瘤侵犯者。符合纳入排除标准的病例共117例,8例由于未完成放疗而排除,最终纳入109例,患者的基本临床资料列于表1。
| 表1 109例患者的基本临床资料 |
2. 放疗定位及靶区勾画:定位采用美国GE公司4排大孔径CT,患者仰卧平躺在模拟CT定位扫描床上,用热塑头颈肩面罩固定后完成定位CT扫描,获取扫描图像后传输至Pinnacle计划系统工作站进行靶区勾画[4]。
靶区和危及器官(OAR)的勾画均根据文献[5]中的定义,在治疗计划系统的CT图像上进行逐层勾画。靶区包括鼻咽大体肿瘤体积(GTVnx)、颈部大体肿瘤体积(GTVnd)、临床靶体积1(CTV1)、临床靶体积2(CTV2),同时勾画脑干、脊髓、腮腺、下颌下腺等敏感器官。OAR外扩3 mm为计划危及器官(PRV),[JP2]PRV的限制剂量参考文献[6]中的要求进行设定。靶区处方剂量均以计划靶体积(PTV)定义给予。PTV包括:PGTVnx、PGTVnd、PCTV1和PCTV2,分别为GTVnx、GTVnd、CTV1、CTV2外扩3 mm。靶体积处方剂量: PGTVnx和PGTVnd处方剂量(69.96~74.09)Gy,PCTV1(60.00~65.10)Gy,PCTV2(51.62~57.60)Gy,分割次数29~33次。
3. 放射治疗计划的设计和实施:放疗计划由有经验的物理师进行设计,所有患者均实行9野调强放疗,机架角度分别为160°、120°、80°、40°、0°、320°、280°、240°、200°。计划评估利用等剂量曲线和剂量体积直方图进行。正常器官在剂量限定范围内越小越好;100%处方剂量线至少包括95%的PTV;PTV接受>110%的处方剂量的体积应<10%;PTV接受<93%的处方剂量的体积应<1%;PTV外的任何地方不能出现>110%的处方剂量[6]。
摆位验证时按照模拟CT定位时的体位进行摆位固定,进行CT扫描并采用骨性标志与定位时的CT图像进行匹配,当验证误差≤3 mm时,验证通过。复位准确后开始放疗,采用6 MV X射线直线加速器(美国Varian公司,6EX),每周5次,连续放疗6~7周。
4. 化疗:病理分期Ⅰ期、部分Ⅱ期及部分不能耐受化疗患者行单纯放疗,部分Ⅱ期及所有Ⅲ~Ⅳ期的患者均接受2~3周期同步放化疗,联合或不联合2~3周期新辅助化疗。同步化疗采用单药顺铂,100 mg/m2,第1天,每隔21 d为1个周期;新辅助化疗采用顺铂60 mg/m2,第1天+多西他赛60 mg/m2,第1天+5-氟尿嘧啶600 mg/m2,第1~5天(或持续静脉泵入120 h),每隔21 d为1个周期。
5. 不良反应观察及评价:每例患者在放疗前及放疗结束后1周内均由两名以上医师对其进行急性放射性口干评价(RTOG/EORTC);如意见不同,则请第三者介入,讨论达成一致。
统计两组患者的年龄、是否合并3度以上黏膜炎、化疗方式等临床资料,同时根据DVH图对左右腮腺、左右下颌下腺及涎腺(腮腺+下颌下腺)的剂量进行整体评估。
6. 统计学处理:采用SPSS 20.0软件进行统计分析,计数资料采用χ2检验;计量资料以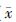 ±s表示,采用独立样本t检验;利用Logistic多因素回归法,并通过计算相对危险比(OR)以及95%可信范围(95%CI)来估计能够区分急性重度放射性口干和非重度放射性口干的独立剂量预测因子。对Logistic回归所得出的独立预测因子进一步进行受试者工作特征曲线(receiver operating characteristics curves,ROC)分析,选择一最佳截断点(即敏感性和特异性最佳的点)作为诊断参考值。P<0.05为差异有统计学意义。
±s表示,采用独立样本t检验;利用Logistic多因素回归法,并通过计算相对危险比(OR)以及95%可信范围(95%CI)来估计能够区分急性重度放射性口干和非重度放射性口干的独立剂量预测因子。对Logistic回归所得出的独立预测因子进一步进行受试者工作特征曲线(receiver operating characteristics curves,ROC)分析,选择一最佳截断点(即敏感性和特异性最佳的点)作为诊断参考值。P<0.05为差异有统计学意义。
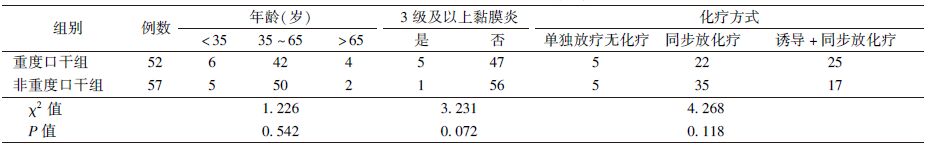
1. 两组患者一般资料的比较:非重度口干组和重度口干组之间患者的年龄、是否合并3度以上黏膜炎、化疗方式等方面比较,差异均无统计学意义(表2)。
| 表2 两组患者一般资料比较(例) |
2. 口干情况:放疗后出现0和1级口干的患者涎腺功能在放疗后大多可以较好地恢复,为非重度口干组。2级及以上口干的患者往往有重度到完全口干、唾液黏稠或者明显味觉改变,为重度口干组。入组的109例患者放疗前均无口干,放疗后非重度口干组的患者共有57例(52.3%),重度口干组的患者共有52例(47.7%)。
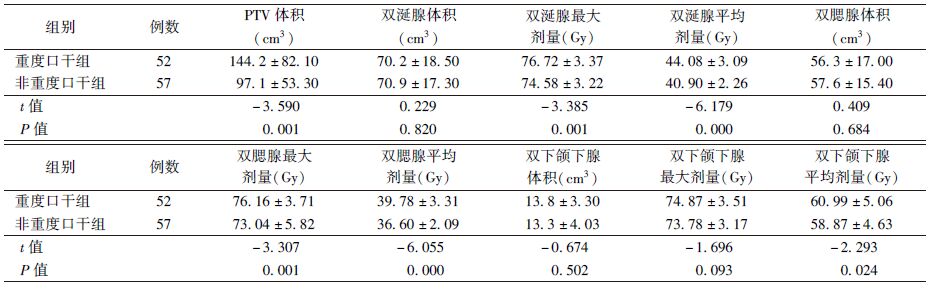
3. 两组患者剂量学指标的比较:非重度口干与重度口干组比较,两组之间PTV体积、双侧涎腺最大照射剂量及平均照射剂量、双侧腮腺最大照射剂量及平均照射剂量、双侧下颌下腺平均照射剂量等剂量学数据之间差异均有统计学意义(t=-3.590、-3.385、-6.179、-3.307、-6.055、-2.293、P<0.05,表3)。双侧涎腺体积、双侧腮腺体积、双侧下颌下腺体积及双侧下颌下腺最大照射剂量之间比较,两组差异无统计学意义。
表3 两组患者剂量学指标比较(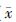 ±s) ±s)
|
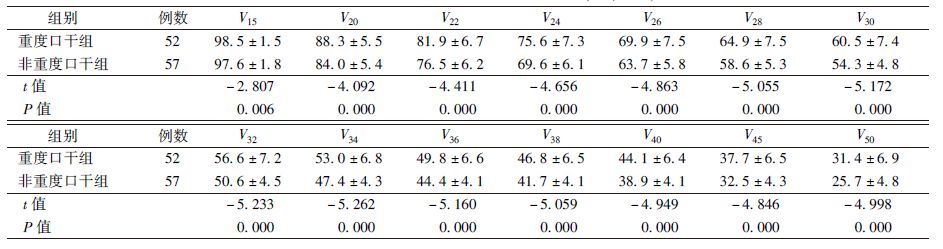
4. 重度口干最佳剂量界值点的确定:双侧腮腺V15~V50数据t检验的结果表明,非重度口干与重度口干组之间的差异均有统计学意义(t=-2.807~-5.262,P<0.05,表4)。以双侧腮腺V15~V50体积受到的照射剂量作为自变量,急性重度放射性口干作为因变量,对入组患者双侧腮腺相应剂量受到的照射体积(V15~V50)进行Logistic回归分析,结果显示,V15~V50中,V34对急性重度口干发生的作用是显著的,Wald值最大(17.375),相对危险比OR=1.231,P<0.05,95%CI:1.116~1.357。由此可见,V34是急性重度放射性口干的独立预测因子。
表4 两组患者双侧腮腺剂量学指标比较(%,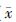 ±s) ±s)
|
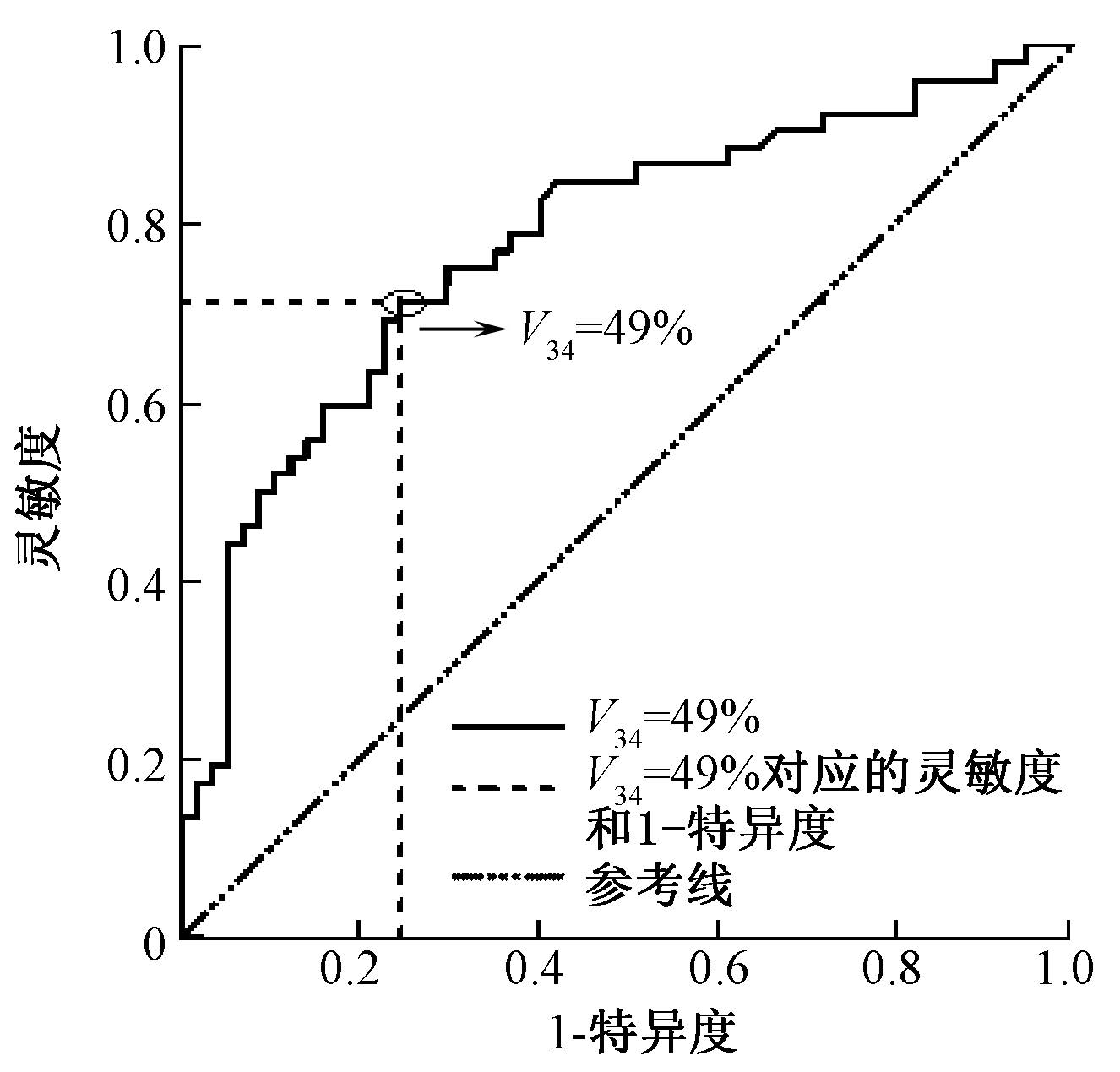
将109例患者的V34进行ROC曲线分析,ROC曲线下的面积(AUC)为0.777。曲线上V34=49%的诊断点对应的敏感度和特异度分别为71.2%和75.4%,尤登指数(敏感度+特异度-1)为最大值。因此,V34=49%是区分急性重度口干和非重度口干的最佳界值(图1)。V34<49%的患者组急性重度口干的发生率为25.8%(15/58),而V34≥49%的患者组急性重度口干的发生率为72.5%(37/51),两组间差异具有统计学意义(χ2=23.710,P<0.05)。
|
图1 109例患者V34的ROC曲线图 |
急性放射反应是指从放疗第1天开始到放疗结束后90 d之内出现的放射治疗反应。急性放射性口干的预测与预防一直是头颈部肿瘤放疗关注的热点,在所有放疗后会发生口干的癌症中,鼻咽癌口干发生率最高且最严重[7]。作为鼻咽癌调强放疗最常见的不良反应之一,急性放射性口干一般在放疗开始1~2周后会出现。由于放射线导致腺泡早期损伤,唾液腺的分泌显著下降,患者会出现咀嚼吞咽功能障碍及口腔状况变化,继而出现急性放射性口干。晚期放射性口干的发生主要与治疗结束后涎腺腺泡再生的情况和组织纤维化的程度有关,与急性放射性口干的严重性没有明显的依赖关系[8]。由于急性放射性口干与放疗剂量密切相关,本研究主要探索急性放射性口干与涎腺放疗剂量的关系。
国内外已有较多放疗剂量与口干关系的研究。Eisbruch等[9]对腮腺剂量的研究发现,受照射平均剂量>26 Gy时腮腺刺激性分泌率会明显下降。Hey等[10]认为,若至少一侧的腮腺能够达到Dmean<26 Gy,唾液流率即可以恢复到放疗前的水平。Tribius等[11]研究表明,若患者左右两侧腮腺受到的照射剂量均能够<26 Gy,而不仅仅是对其进行平均剂量进行限定,患者口干的发生率和严重程度会明显下降。目前对腮腺的最佳限定剂量尚存争议。Ortholan等[12]推荐双侧腮腺受到40 Gy以上剂量照射的体积应该<33%;而Moiseenko等[13]通过对受到射线照射较少的一侧腮腺进行剂量限定,认为当其平均剂量<20 Gy时,口干的发生率不到20%,并且进行Logistic回归后得出这一侧腮腺的D50为32.4 Gy。
刺激时涎液主要由腮腺产生,而静息时约70%的涎液是由下颌下腺分泌。由于头颈部解剖结构精细,下颌下腺受到照射剂量往往比较高,因此,对下颌下腺进行保护的患者放疗后涎腺功能恢复更加好,口干发生降低。有研究表明,当下颌下腺受照射的平均剂量>39 Gy时,刺激性下颌下腺流率会呈指数递减,而当下颌下腺平均剂量≤39 Gy时,放疗后其功能会逐渐恢复[14]。
口干的发生与放疗剂量密不可分,减少涎腺受照射的剂量是减少口干发生的根本措施。虽然国内外已经有许多对腮腺和下颌下腺剂量限定方面的研究,但是为保证靶区剂量,对涎腺剂量的限定在临床上常难以达到。本研究入组的病例在制定放疗计划时对左、右腮腺的剂量限定为:至少一侧达到V30<50%,但对于局部肿物较大或分期较晚的患者,这样的腮腺剂量限定往往达不到。本研究中,急性重度口干组腮腺的平均剂量为39 Gy左右,非重度口干组为36 Gy左右,腮腺受到的平均照射剂量仍然较高,且两组之间差异有统计学意义。下颌下腺在制定放疗计划时未进行剂量限定,重度口干组的平均剂量为60 Gy左右,非重度口干组为58 Gy左右,两组平均剂量之间差异也具有统计学意义。因此,如何在剂量限定达不到要求的时候减少重度口干的发生,提高患者的生活质量仍待研究。不能忽视的是,尽管很多研究关注唾液流率的测定及变化,但是患者的主观口干感觉常常是与唾液流率是不一致的[15],以患者主观口干感觉及RTOG评分为观察终点的研究或许临床意义更大[16],且急性放射性非重度口干多在放疗后可以得到缓解,而急性重度口干(2级及以上)在放疗后多难以恢复,严重影响了患者的生活质量,如何在保证放疗效果的同时减少急性重度口干的发生需要进一步探索。
本研究前瞻性的观察了109例鼻咽癌调强放疗患者涎腺照射剂量的变化,目的是分析患者发生急性放射性重度口干与放疗剂量的关系,寻找减少急性重度放射性口干的最佳剂量限定值。放疗后重度口干发生率为47.7%(52/109),发生率较高。重度口干组与非重度口干组之间临床因素进行比较,差异均无统计学意义,年龄、黏膜炎以及化疗方式并不会影响口干发生的严重程度。其次,本研究对双侧腮腺相应剂量受到的照射体积(V15~V50)分析结果显示,双侧腮腺的V34是急性重度放射性口干的独立预测因子,V34=49%时急性重度口干和非重度口干可以被更好地区分。因此,V34=49%或许可以作为剂量学指标来评估急性重度放射性口干的发生风险,结果尚待进一步研究证实。目前,国内外的研究以对腮腺平均剂量的研究多见,且多为单侧腺体的单独评估,而对双侧腮腺整体进行评价的相关文献报道极少。急性放射性口干的发生由左、右两侧腮腺及下颌下腺共同引起,在放疗计划评估时对双侧涎腺功能整体进行剂量学的评价或许对患者口干预防及治疗的意义更大。虽然急性放射性口干与许多因素相关,此研究的创新性在于,从临床角度出发对急性放射性口干患者进行分组,并对两组相关数据进行统计和比较,分析了引起急性放射性重度口干的影响因素及相关预测因子。对于鼻咽癌调强放疗患者,尤其是局部肿块较大或分期较晚的患者,腮腺的剂量的限定往往达不到Dmean<26 Gy或V30<50%,如果对双侧腮腺的V34进行剂量限定或许可以更好地减少急性放射性重度口干的发生,从而提高患者的生活质量。
本研究还存在以下不足,仅对急性放射性口干进行了分析,而未随访远期口干反应状况;下颌下腺未进行限量,其对口干的影响及其剂量学关系有待进一步研究;对双侧腮腺、双侧下颌下腺及双侧涎腺的靶区进行整体评估的方法尚待进一步研究。
总之,预防急性放射性口干的最主要途径是在降低正常组织受照剂量的同时,也降低受照射体积。在对腮腺及下颌下腺剂量限定时,建议考虑其临床放疗反应,必要时对V34进行剂量限定,这样或许可以更好地对腺体进行保护,减少急性重度口干的发生。
| [1] | Vergeer MR, Doornaert PAH, Rietveld DHF, et al. Intensity-modulated radiotherapy reduces radiation-induced morbidity and improves health-related quality of life: Results of a nonrandomized prospective study using a standardized follow-up program[J]. Int J Radiat Oncol Biol Phys, 2009,74(1):1-8. |
| [2] | Bahrain A,Mujaheddin A,Niazm A,et al. Evaluation of irradiated salivary gland function in patients with head and neck tumours treate with radiontherapy[J].J Laryngol Otol,2009,123(1):108-113. |
| [3] | Dirix P, Nuyts S, Van den Bogaert W. Radiation-induced xerostomia in patients with head and neck cancer: a literature review[J]. Cancer, 2006, 107(11):2525-2534. |
| [4] | Lin SJ,Pan JJ,Han L,et al.Nasopharyngeal carcinoma treated with reduced-volume intensity-modulated radiation therapy:report on the 3-year outcome of a prospective seres[J].Int J Radiat Oneol Biol Phys,2009,75(4):1071-1078. |
| [5] | 陈传本, 潘建基, 陈荔莎, 等. 调强放疗条件下鼻咽癌原发肿瘤体积对预后的影响[J]. 中华放射肿瘤学杂志, 2012, 21(3): 205-208. |
| [6] | 高颖川, 朱小东, 李龄, 等. 339例鼻咽癌调强放疗临床疗效分析[J]. 中国肿瘤临床, 2012, 39(24): 2029-2035. |
| [7] | Huguenin PU, Taussky D, Moe K, et al. Quality of life in patients cured from a carcinoma of the head and neck by radiotherapy: the importance of the target volume[J]. Int J Radiat Oncol Biol Phys,1999,45(1):47-52. |
| [8] | Koukourakis MI, Danielidis V. Preventing radiation induced xerostomia[J]. Cancer Treat Rev, 2005,31(7):546-554. |
| [9] | Eisbruch A,Ten Haken RK,Kim HM, et al. Dose, volume, and function relationships in parotid salivary glands following conformal and intensity-modulated irradiation of head and neck cancer[J]. Int J Radiat Oncol Biol Phys, 1999, 45 (3):577-587. |
| [10] | Hey J, Setz J, Gerlach R, et al. Parotid gland-recovery after radiotherapy in the head and neck region-36 months follow-up of a prospective clinical study[J]. Radiat Oncol, 2011,(6):125. |
| [11] | Tribius S, Sommer S, Tennstedt P, et al. Xerostomia after radiotherapy. What matters - mean total dose or dose to each parotid gland?[J]. Strahlenther Onkol, 2013, 189(3):216-222. |
| [12] | Ortholan C, Chamorey E, Benezery K, et al. Modeling of salivary production recovery after radiotherapy using mixed models: determination of optimal dose constraint for IMRT planning and construction of convenient tools to predict salivary function[J]. Int J Radiat Oncol Biol Phys, 2009, 73(1): 178-186. |
| [13] | Moiseenko V, Wu J, Hovan A, et al. Treatment planning constraints to avoid xerostomia in head-and-neck radiotherapy: an independent test of QUANTEC criteria using a prospectively collected dataset[J]. Int J Radiat Oncol Biol Phys, 2012, 82(3): 1108-1114. |
| [14] | Murdoch-Kinch CA, Kim HM, Vineberg KA, et al. Dose-effect relationships for the submandibular salivary glands and implications for their sparing by intensity modulated radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2008, 72(2): 373-382. |
| [15] | Vissink A, Mitchell JB, Baum BJ, et al. Clinical management of salivary gland hypofunction and xerostomia in head-and-neck cancer patients: successes and barriers [J]. Int J Radiat Oncol Biol Phys, 2010, 78(4): 983-991. |
| [16] | Jensen SB, Pedersen AML, Vissink A, et al. A systematic review of salivary gland hypofunction and xerostomia induced by cancer therapies: management strategies and economic impact[J]. Support Care Cancer, 2010, 18(8): 1061-1079. |
 2015, Vol. 35
2015, Vol. 35