放射性皮肤损伤创面难以愈合的的病理学基础是血管再生微环境差,包括细胞因子和生长因子表达减弱、胶原合成减少和基质蛋白酶过量堆积等[1, 2, 3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管再生中重要的调控因子之一,也是目前发现最强的促血管内皮细胞有丝分裂原,可特异性作用于血管内皮细胞,促进其增殖,增加血管内皮的通透性及促进新生血管形成[4, 5]。Goessler等[6]和Riedel等[7]研究显示,电离辐射后的皮肤溃疡处表皮细胞、成纤维细胞及血管内皮细胞中VEGF的转录及表达水平下降可能是放射性皮肤溃疡不愈合的重要原因,这也为外源性VEGF在放射性皮肤溃疡创面的应用提供了理论依据。但目前通过局部应用VEGF或转基因表达VEGF来改善放射性皮肤损伤的愈合效果在国内外尚未见报道。为此,本研究利用放射性皮肤损伤大鼠模型探讨转染VEGF细胞对放射性皮肤溃疡修复的促进效果,评价该治疗方法应用于放射性损伤的可行性及作用机制,为临床治疗各种放射性损伤及其他缺血性疾病提供一种新途径。
1. 实验动物、主要试剂和仪器:SD大鼠(3~5 d龄),购自山西医科大学实验动物中 心,动物合格证号:SCXK(晋)2009-001;SD清洁级雄性大鼠24只,体重(400±20)g,由中国人民解放军军事医学科学院动物中心提供。TRIzol试剂(美国Invitrogen公司)和cDNA合成试剂盒(上海生工公司)、SybrGreen PCR Master Mix(美国ABI公司);兔抗人VEGF抗体、通用型广谱二抗(北京中杉金桥公司);二氧化碳培养箱(美国Thermo公司);荧光定量PCR仪(美国ABI公司);凝胶成像系统(上海复日科技有限公司);倒置相差显微镜(日本Olympus公司);60Co照射仪(中国核动力院)。
2.原代成纤维细胞的培养和腺病毒介导的hVEGF基因转染:重组腺病毒AdmaxTM-EGFP-VEGF165载体由上海吉凯基因化学技术有限公司构建。采用组织块贴壁法进行大鼠原代成纤维细胞的分离培养[8],取第2~4代70%~80%汇合的细胞进行转染,分为VEGF转染组(转染AdmaxTM-EGFP-VEGF165)和空载体组(转染AdmaxTM-EGFP),感染复数(multiplicity of infection,MOI)为1[DK]∶100,48 h后收集细胞。
3. 细胞内hVEGF表达
(1)荧光定量PCR:提取细胞总RNA,反转录,设计特定引物进行PCR,人VEGF165(NM00171626),上游引物:5′ CCCACTGAGGAGTCCAACATC 3′,下游引物:5′ GTCTTGCTCTATCTTTCTTTGGTCT 3′,以管家基因GAPDH为内参,上游引物:5′ CAAGTTCAACGGCACAGTCAA 3′,下游引物:5′ CGCCAGTAGACTCCACGACA 3′,PCR条件为:95℃ 3 min;95℃ 15 s,60℃ 40 s,40个循环。针对VEGF165基因全长设计引物进行普通PCR,上游引物:5′ ATGAACTTTCTGCTGTCTTGGGT 3′,下游引物:5′ TCACCGCCTCGGCTTGTCACATCT 3′,扩增PCR产物为576 bp。
(2)免疫细胞化学检测:取细胞爬片行免疫细胞化学染色,一抗为兔抗人VEGF,二抗为通用型二抗,PBS为阴性对照。光学显微镜观察,胞质呈棕黄色为阳性细胞。
(3)Western blot检测:提取细胞总蛋白,进行聚丙烯酰氨凝胶电泳,转膜、封闭,加兔抗人VEGF抗体、孵育、洗膜、加二抗,行底物化学发光(ECL)后曝光,并读取结果。
4. 大鼠放射性皮肤损伤的制备及处理方法:取24只清洁级SD大鼠,采用0.3%戊巴比妥钠(1 ml/100 g)腹腔注射麻醉,60Co γ射线照射大鼠臀部及双腿,铅块遮挡直肠区域及其他非照射区,照射野面积为2 cm×4 cm,源皮距80 cm,一次性照射剂量为50 Gy。照后动物单笼饲养。照后7 d,动物按随机数字表法随机分为VEGF转染组和空转染组,前者双腿内侧皮下注射0.5 ml转染hVEGF165的成纤维细胞,后者双腿内侧相同方式注射0.5 ml空载体转染的成纤维细胞。观察时间:处理后3 d,1、2、5周。
5. 大鼠放射性皮肤损伤愈合的观察指标
(1)大体变化及创面最大溃疡面积:观察记录大鼠受照区皮肤变化、出现溃疡的时间和创面愈合时间。各观察时间点每组按随机数字表法随机抽取3只动物,双腿受照区均取样,如出现溃疡,则利用透明模片拓取溃疡面积,采用图像处理软件计算创面最大溃疡面积。同时,迅速切取溃疡创面及周围5 mm正常皮肤组织(愈合的则取愈后局部组织),一部分4%甲醛固定,HE染色;另一部分投入液氮,行组织中mRNA含量测定。
(2)皮肤组织HE染色:经4%甲醛固定后的标本依次经过脱水、浸蜡、包埋、常规切片,HE染色后光镜观察。
(3)荧光定量PCR检测皮肤中hVEGF-165mRNA和rVEGF-A mRNA含量:取出液氮中保存的皮肤组织样品,提取总RNA,反转录,利用特定引物对目的片段进行扩增。hVEGF-165引物同前所述。rVEGF-A上游引物:5′ GCAGCGACAAGGCAGACTATT 3′,下游引物:5′ ACCGTTGGCACGATTTAAGAG 3′,扩增产物长度为155 bp。管家基因同前。引物由上海生工公司设计合成。PCR反应条件:95℃3 min,1个循环;95℃15 s、60℃40 s,40个循环。
6. 统计学处理:计量资料以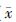 ±s表示。采用SPSS 19.0软件进行分析。两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD法。P<0.05为差异有统计学意义。
±s表示。采用SPSS 19.0软件进行分析。两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD法。P<0.05为差异有统计学意义。
1. 转染细胞VEGF 165 mRNA表达水平:hVEGF165基因全长为576 bp,电泳结果显示VEGF转染组PCR扩增产物于576 bp附近出现一条清晰条带,而空转染组对应位置条带模糊,证实为VEGF165基因已成功转染入成纤维细胞。荧光定量PCR结果显示以GAPDH为内参基因,VEGF转染组与空转染组相比,VEGF165mRNA相对表达量显著上调,为后者的88 373.12倍。
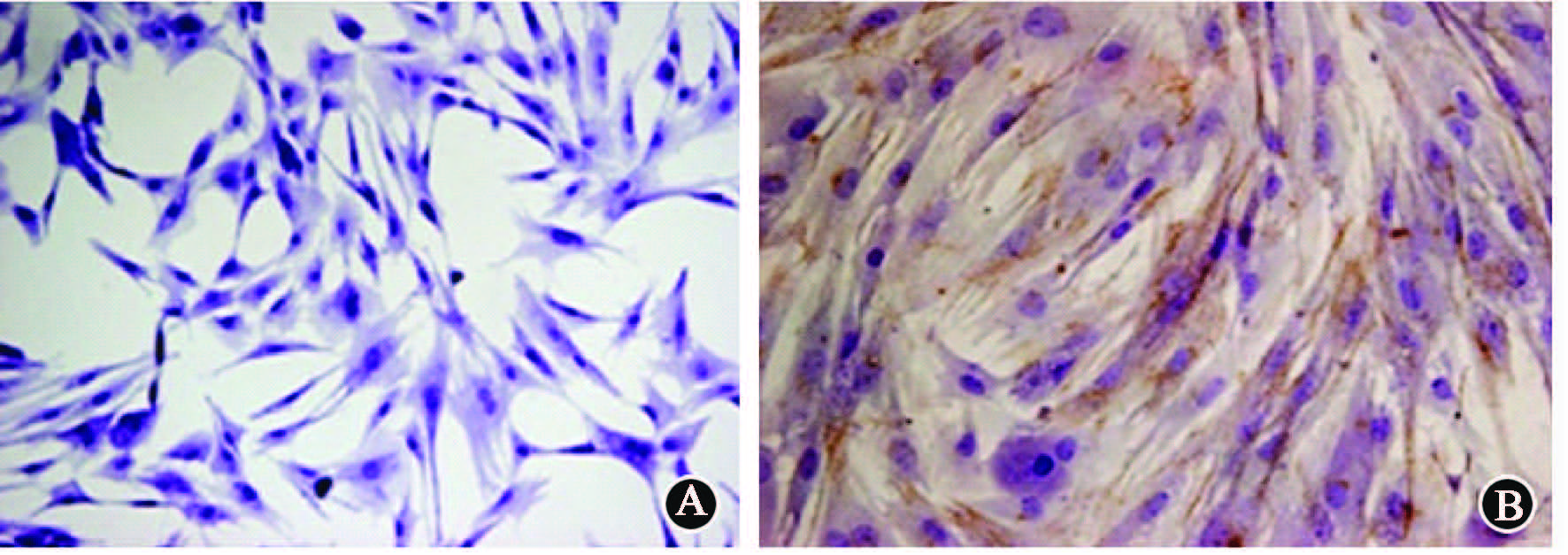
2. 免疫组织化学染色检测细胞内VEGF165蛋白表达: VEGF165蛋白在胞质中表达,胞质呈棕黄色染色者即说明细胞内有VEGF165蛋白表达,即阳性表达。结果显示,VEGF转染组有大量阳性细胞,而空转染组几乎无细胞呈阳性表达(图1)。
|
图1 转染细胞体外hVEGF165表达免疫组织化学染色 A. 空转染组;B. hVEGF转染组 ×200 |
3. Western blot检测细胞内VEGF165 蛋白表达:转染VEGF组在23 000左右出现特异性条带,而空转染组则未见该条带(图2)。
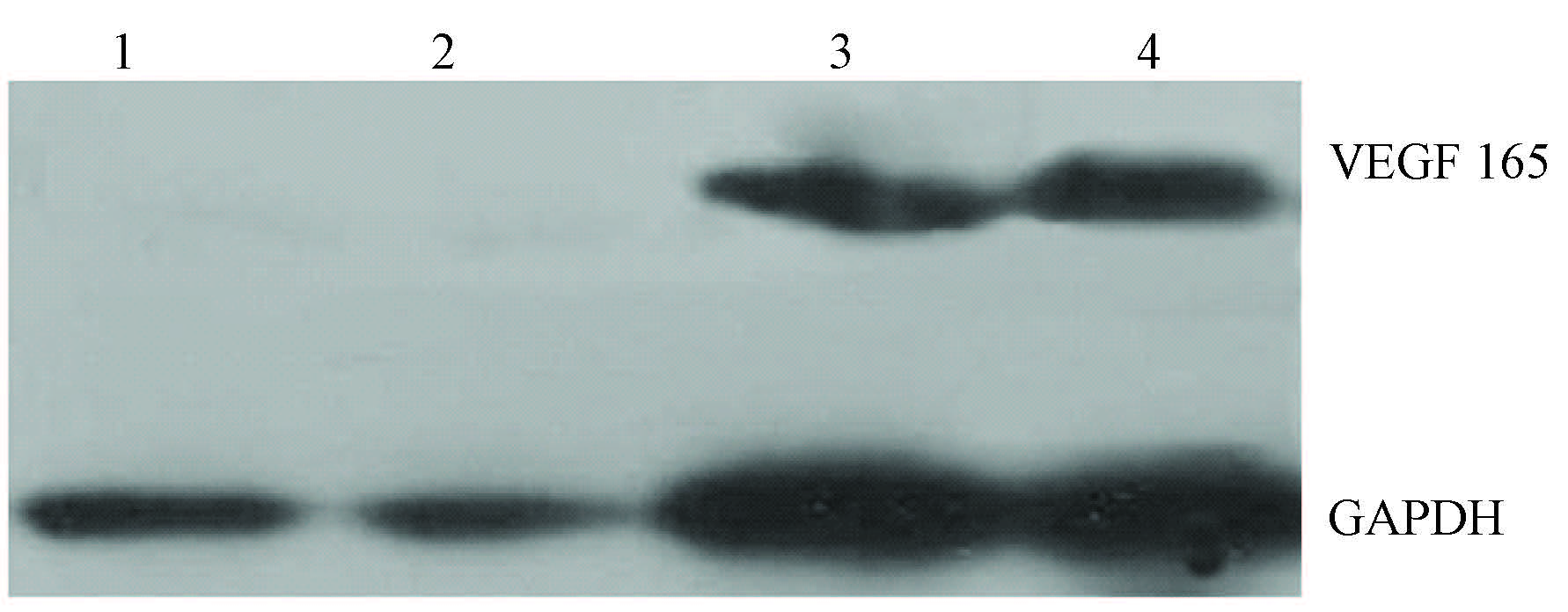
|
图2 转染细胞体外hVEGF165表达Western blot检测 注:1和2为空转染组,3和4为hVEGF转染组 |
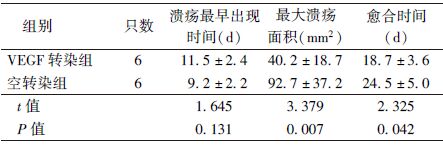
4. 放射性皮肤损伤愈合的肉眼观察:两组所有大鼠受照后均于不同时间出现不同程度溃疡,其中空转染组受照皮肤从处理后1周开始出现红肿、脱毛,第2周左右出现皲裂,且局部有组织液渗出,小面积溃疡形成,至第3周左右溃疡面不再增大、渗出减少且开始出现结痂,第4周左右溃疡面基本愈合,但偶有再破溃,约第5周溃疡面全部愈合,被毛覆盖。与之相比,hVEGF165转染组皲裂、渗出较少,溃疡最早出现的时间延迟,平均相差约2 d,但差异无统计学意义;溃疡范围较小,平均最大溃疡面积为40.2 mm2,比对照组平均减少52.5 mm2,达到57%,差异有统计学意义(t=3.379,P<0.05);愈合时间明显缩短,相差约6 d,差异有统计学意义(t=2.325,P<0.05,表1)。
表1 各组放射性皮肤损伤的愈合效果(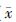 ±s) ±s)
|
5. 放射性皮肤损伤愈合的组织学观察:处理后3 d,hVEGF165转染组表皮层连续,细胞肿胀,基底层明显,真皮内小血管扩张、充血,白细胞边集,少量中性粒细胞和淋巴细胞浸润,毛囊和皮脂腺体积缩小,部分细胞核固缩或消失。而空转染组部分表皮细胞变性、坏死,小血管闭塞。1周后,hVEGF转染组表皮细胞坏死、脱落,周围细胞增生,形成表皮脚,真皮胶原纤维变性、断裂,毛囊和腺体萎缩,数量减少,细胞核消失,中性粒细胞、淋巴细胞增多。空转染组表皮坏死范围扩大,大量中性粒细胞和淋巴细胞聚集,偶见巨噬细胞。2周后,hVEGF转染组周边表皮细胞增生,并向溃疡中心迁移爬行,真皮内增生的成纤维细胞及大量小血管,不同阶段的毛囊雏形,基质中炎性细胞明显减少。空转染组真皮层中炎性细胞数量仍很多。5周后,hVEGF165转染组表皮细胞连续覆盖,大量新生毛囊和腺体,成纤维细胞和小血管减少,纤维束形成,炎性细胞消失;空转染组表皮细胞仍有轻度增生(图3)。
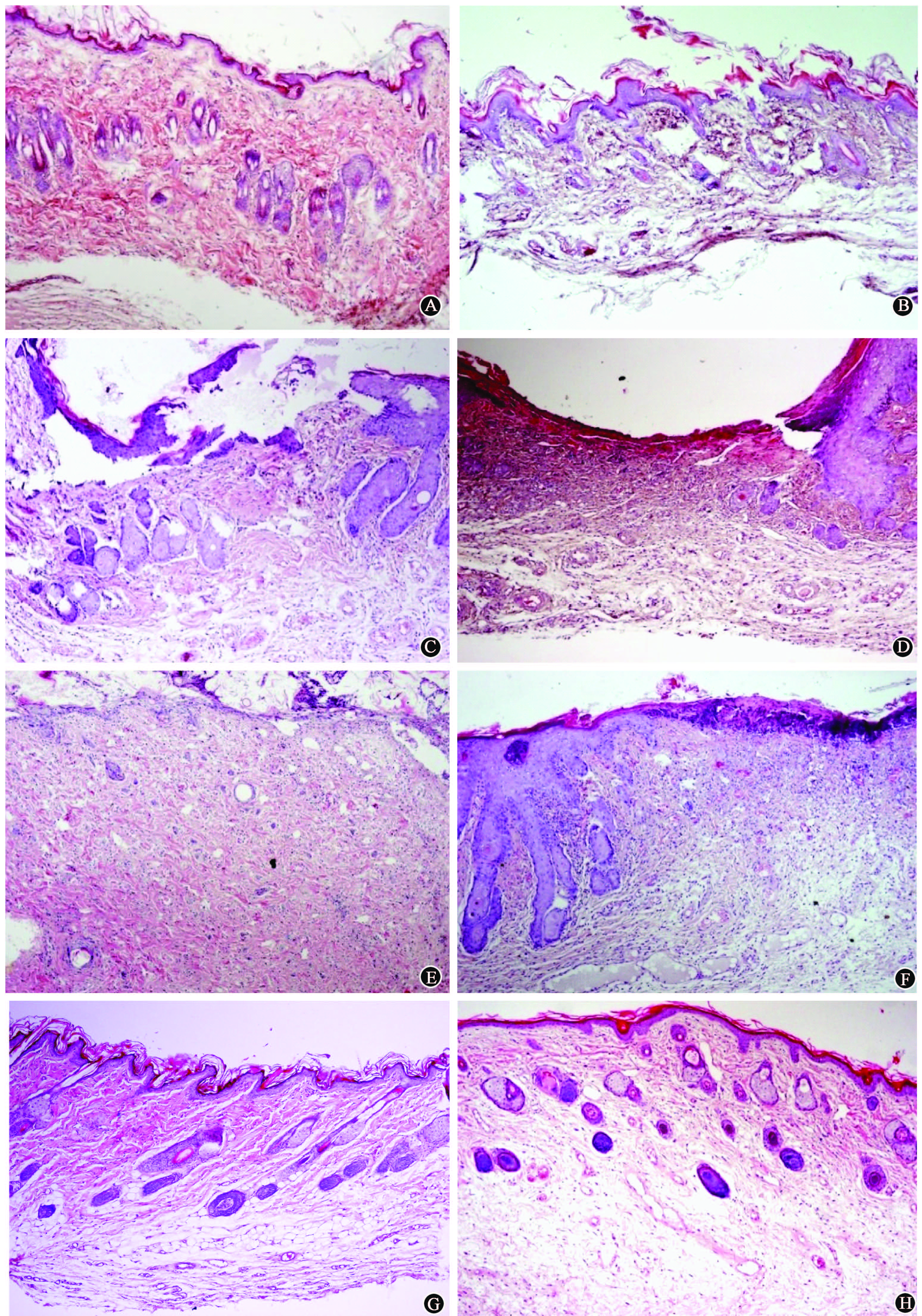
|
图3 不同处理组皮肤损伤愈合的组织学变化 HE染色 ×100 A.处理后3 d hVEGF165转染组;B.处理后3 d空转染组; C.处理后1周hVEGF转染组; D.处理后1周空转染组; E.处理后2周hVEGF转染组; F.处理后2周空转染组; G.处理后5周hVEGF165转染组; H.处理后5周空转染组 |
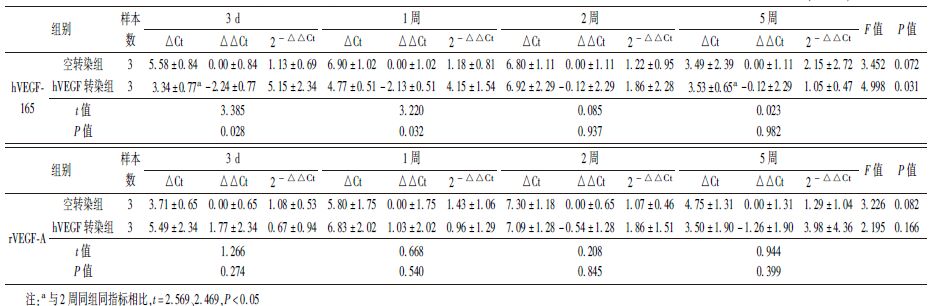
6. 皮肤中hVEGF165和rVEGF-A mRNA表达:hVEGF165转染组hVEGF165 mRNA表达量各时间点均高于空转染组,其中第3天、第1周两组间差异有统计学意义(t=3.385、3.220,P<0.05),前者相对表达量为后者的5.15和4.15倍。hVEGF165转染组第1、第2周基因表达量略有下降,但第5周时又有回升,不同时间点间差异有统计学意义(F=4.998,P<0.05),且第3天、5周hVEGF165 mRNA相对表达量与第2周表达量差异有统计学意义(t=2.569、2.469,P<0.05)。但空转染组hVEGF165 mRNA表达量不同时间点间的差异无统 计学意义。hVEGF165转染组和空转染组内源性rVEGF-A mRNA相对表达量各时间点差异均无统计学意义(表2)。
表2 不同方法治疗放射性皮肤损伤各时间点组织中hVEGF-165和rVEGF-A mRNA的相对表达量 ±s) ±s)
|
电离辐射不仅会损伤皮肤组织中基底细胞为主的表皮细胞、真皮中成纤维细胞、血管内皮细胞的正常形态,而且会影响这些细胞的增殖能力、合成、表达和分泌能力包括细胞因子和基质成分,同时破坏小血管等微循环系统,最终导致放射性皮肤溃疡形成[11]。本研究利用60Co γ射线单次剂量(50 Gy)局部照射大鼠,结果显示,处理后1周皮肤相继出现红肿、脱毛、皲裂、渗出,2周后溃疡形成,组织学表现为表皮细胞肿胀、不同程度坏死、胶原纤维断裂、溶解,小血管闭塞、残存小血管扩张充血,炎性细胞渗出、毛囊和腺体萎缩,核变性,表现为典型的放射性皮肤损伤的病理过程[12, 13],因而证实了采用60Co γ射线单次剂量(50 Gy)局部照射、适当物理屏蔽制备放射性皮肤溃疡的动物模型是可行的。
放射性皮肤损伤病变过程中伴随着一系列的生物学变化,如氧化自由基产生[14, 15]、凋亡基因异常表达[16]、细胞因子和趋化因子(如NF-α、PDGF等)含量改变[17, 18]。依据这些不同的分子机制形成多种治疗策略,包括抗氧化治疗[19, 20]、抗细胞凋亡[21]和细胞因子治疗等[22],但目前尚无统一、公认的治疗方法。基因转染作为一门新兴的分子生物学技术已经逐渐渗入并应用于放射性皮肤损伤等临床治疗领域,如AAV2介导的MnSOD转基因载体、hPDGF-A/hBD2转基因骨髓间充质干细胞,被证实可减缓放射性皮肤损伤、促进辐射损伤创面愈合[23, 24]。
细胞是基因转染的重要载体之一,成纤维细胞是电离辐射的靶细胞[21, 25],也是溃疡形成后创面修复过程中重要的组成细胞,它不仅可以在体外大量扩增,易于遗传改造,而且具有容易移植和不易转化的优点,因此,成为目前基因治疗应用较为广泛的载体。本研究以该细胞为载体,结果显示,转染VEGF组无论转录水平和蛋白水平较空转染组均有明显提高,转录水平mRNA相对表达量可达到空转染组的近104倍,证实成纤维细胞对腺病毒介导的VEGF165基因载体具有良好的接受性,在体外能够实现目的基因的过量表达,可作为基因治疗的工具和载体加以利用,这与Chen和Woodley[26]、Parrilla等[27]的研究结论是一致的。
VEGF在血管再生中具有重要的调控作用,以蛋白注入或基因转染方式外源性应用VEGF对慢性肢体缺血、心肌缺血等缺血性疾病或糖尿病、静脉栓塞等致皮肤溃疡的愈合有促进作用[28, 29, 30],但目前国内外尚未见VEGF治疗放射性皮肤溃疡的报道。本研究以腺病毒介导的hVEGF165基因转染细胞应用于大鼠放射性皮肤损伤,结果显示,hVEGF165转染组平均溃疡面积较空转染组减少52.5 mm2,约57%,同时愈合时间比对照组缩短约6 d,这提示转VEGF基因细胞技术对放射性皮肤溃疡愈合具有一定的促进作用。组织学检测也显示,VEGF转染组在治疗后3 d便出现小血管大量增生,早于空转染组,这与愈合时间提前、溃疡面积减小等大体观察结果相吻合。此外,观察到实验组溃疡出现时间较对照组延迟,呈现减缓放射性皮肤病变出现的趋势,但差异并没有统计学意义,可能与样本量小有关,尚需增加研究样本量进行探讨。
辐射损伤后皮肤愈合过程同样伴随着一系列分子事件如EGF、VEGF表达升高的发生,并提示愈合的进程和发展结局[31]。外源损伤可能激活机体内愈合相关的生长因子的分泌,因此,本研究中接受治疗的大鼠体内VEGF有两种来源,一种为外源导入的hVEGF165基因,另一种为大鼠内源性rVEGF-A基因,为评估皮肤愈合过程中两种来源生长因子的具体作用,研究采用了荧光定量PCR方法检测不同时间点局部皮肤两个基因mRNA的表达量,结果显示,3 d和1周时VEGF转染组的hVEGF mRNA表达量平均为空转染组的5.15和4.15倍,即外源性hVEGF转染细胞可在体内同样高表达hVEGF,但该表达量随观察时间的延长而有减少的趋势。结合大体观察时缩短的愈合时间和减小的愈合面积,可推论外源性导入的生长因子的表达在愈合初期发挥重要作用。根据彭瑞云等[31]研究结果,辐照后5~15 d VEGF皮肤组织中VEGF表达处于较低水平,因而此时外源性基因的导入对辐射损伤诱发的生长因子的减少起到重要的补偿作用,从而利于损伤的修复。同时也显示,大鼠机体内源性rVEGF-A mRNA相对表达量在两处理组间及各观察时间点间均未见明显差异,提示机体内源性生长因子的调动并未受到外源生长因子的表达影响。
总之,本研究基于改善血管再生微环境,从宏观大体观察、组织病理学观察和分子水平的mRNA表达等不同层面证实了转染血管内皮生长因子细胞对修复局部放射性皮肤溃疡具有一定促进作用,该结果不仅验证了VEGF在放射性皮肤溃疡发生中的重要作用,同时目前也尚未见采用血管内皮生长因子基因治疗放射性皮肤溃疡的报道,这将为临床上探求治疗放射性皮肤溃疡等缺血性皮肤损伤提供了一个新方法和新途径。不过,本研究也存在一定局陷,如一些反映辐射损伤过程中基质沉积、胶原重塑的指标包括真皮厚度改变并未得到充分测量,但通过组织学观察真皮胶原纤维形态仍可得到大致评估。此外,外源性VEGF基因的导入促进放射性皮肤溃疡的机制还并未完全清晰,更多的分子生物学机制尚需要进一步研究探讨。
| [1] | 谷庆阳, 王德文. 不同剂量照射对大鼠伤口愈合影响规律的分子病理学研究[J]. 中华放射医学与防护杂志, 1998, 18(3): 166-169. |
| [2] | Gu Q, Wang D, Gao Y, et al. Expression of MMP1 in surgical and radiation-impaired wound healing and its effects on the healing process[J]. J Environ Pathol Toxicol Oncol, 2002, 21(1):71-78. |
| [3] | Kim JH, Kolozsvary AJJ, Jenrow KA, et al. Mechanisms of radiation-induced skin injury and implications for future clinical trials[J]. Int J Radiat Biol, 2013, 89(5): 311-318. |
| [4] | Ching YH,Sutton TL, Pierpont YN, et al. The use of growth factors and other humoral agents to accelerate and enhance burn wound healing[J]. Eplasty, 2011,11(e41):429-449. |
| [5] | Bao P, Kodra A, Tomic-Canic M, et al. The role of vascular endothelial growth factor in wound healing[J]. J Surg Res, 2009, 153(2): 347-358. |
| [6] | Goessler UR, Bugert P, Kassner S, et al. In vitro analysis of radiation-induced dermal wounds[J]. Otolaryngol Head Neck Surg, 2010, 142(6):845-850. |
| [7] | Riedel F, Philipp K, Sadick H, et al. Immunohistochemical analysis of radiation-induced non-healing dermal wounds of the head and neck[J]. In Vivo, 2005, 19(2): 343-350. |
| [8] | 董丽, 周沫, 李宝兴, 等. 组织工程皮肤种子细胞生物学特性的研究[J]. 西部医学, 2009, 21(4): 553-555. |
| [9] | Olascoaga A, Vilar-Compte D, Poitevin-Chacon A, et al. Wound healing in radiated skin: pathophysiology and treatment options[J]. Int Wound J, 2008, 5(2): 246-257. |
| [10] | Peter RU. Cutaneous radiation syndrome after accidental skin exposure to ionizing radiation[J]. Hautarzt, 2013, 64(12): 894-903. |
| [11] | Lorette G, Machet L. Radiation-induced skin toxicities: prevention, treatment[J]. Cancer Radiother, 2001, 5( Suppl 1):116-120. |
| [12] | 谷庆阳. 急性放射性皮肤溃疡发生发展过程中VEGF的表达水平与单纯伤口愈合的对比研究[J]. 中国辐射卫生, 2002, 11(4):196-197. |
| [13] | 沈国良, 陆兴安, 唐俊, 等. 大鼠急性射线皮肤损伤动物模型的建立与应用[J]. 中华放射医学与防护杂志, 2006, 26(6):577-579. |
| [14] | Riley PA. Free radicals in biology: oxidative stress and the effects of ionizing radiation[J]. Int J Radiat Biol, 1994, 65(1):27-33. |
| [15] | Borghini A, Vecoli C, Mercuri A, et al. Genetic risk score and acute skin toxicity after breast radiation therapy[J]. Cancer Biother Radiopharm, 2014, 29(7): 267-272. |
| [16] | Jadhav SS, Meeks CJ, Mordwinkin NM, et al. Effect of combined radiation injury on cell death and inflammation in skin[J]. Apoptosis, 2015, 20(7): 892-906. |
| [17] | Kim JS, Rhim KJ, Jang WS, et al. β-irradiation (166Ho patch)-induced skin injury in mini-pigs: effects on NF-κB and COX-2 expression in the skin[J]. J Vet Sci, 2015, 16(1): 1-9. |
| [18] | Yan G, Sun H, Wang F, et al. Topical application of hPDGF-A-modified porcine BMSC and keratinocytes loaded on acellular HAM promotes the healing of combined radiation-wound skin injury in minipigs[J]. Int J Radiat Biol, 2011, 87(6): 591-600. |
| [19] | Doctrow SR, Lopez A, Schock AM, et al. A synthetic superoxide dismutase/catalase mimetic EUK-207 mitigates radiation dermatitis and promotes wound healing in irradiated rat skin[J]. J Invest Dermatol, 2013, 133(4): 1088-1096. |
| [20] | Watanabe S, Fujita M, Ishihara M, et al. Protective effect of inhalation of hydrogen gas on radiation-induced dermatitis and skin injury in rats[J]. J Radiat Res, 2014, 55(6): 1107-1113. |
| [21] | Kim JH, Jenrow KA, Brown SL. Mechanisms of radiation-induced normal tissue toxicity and implications for future clinical trials[J]. Radiat Oncol J, 2014, 32(3): 103-115. |
| [22] | Kang HC, Ahn SD, Choi DH, et al. The safety and efficacy of EGF-based cream for the prevention of radiotherapy-induced skin injury: results from a multicenter observational study . Radiat Oncol J,2014,32(3):156-162. |
| [23] | Yan S, Brown SL, Kolozsvary A, et al. Mitigation of radiation-induced skin injury by AAV2-mediated MnSOD gene therapy[J]. J Gene Med, 2008, 10(9): 1012-1018. |
| [24] | Hao L, Wang J, Zou Z, et al. Transplantation of BMSCs expressing hPDGF-A/hBD2 promotes wound healing in rats with combined radiation-wound injury[J]. Gene Ther, 2009, 16(1): 34-42. |
| [25] | Grudzenski S, Raths A, Conrad S, et al. Inducible response required for repair of low-dose radiation damage in human fibroblasts[J]. PNAS, 2010, 107(32):14205-14210. |
| [26] | Chen M, Woodley DT. Fibroblasts as target cells for DEB gene therapy[J]. J Invest Dermatol, 2006, 126(4): 708-710. |
| [27] | Parrilla C, Lattanzi W, Rita Fetoni A, et al. Ex vivo gene therapy using autologous dermal fibroblasts expressing hLMP3 for rat mandibular bone regeneration[J]. Head Neck, 2010, 32(3): 310-318. |
| [28] | Muona K, Mkinen K, Hedman M, et al. 10-year safety follow-up in patients with local VEGF gene transfer to ischemic lower limb[J]. Gene Ther, 2012, 19(4):392-395. |
| [29] | Hedman M, Muona K, Hedman A, et al. Eight-year safety follow-up of coronary artery disease patients after local intracoronary VEGF gene transfer long-term safety of VEGF gene therapy[J]. Gene Ther, 2009, 16(5): 629-634. |
| [30] | Brem H, Kodra A, Golinko MS, et al. Mechanism of sustained release of vascular endothelial growth factor in accelerating experimental diabetic healing[J]. J Invest Dermatol, 2009, 129(9): 2275-2287. |
| [31] | 彭瑞云, 高亚兵, 熊呈琦, 等. 正常和放射复合伤口血管再生中VEGF基因的表达及其意义[J]. 细胞与分子免疫学杂志, 2001, 17(5): 410-412. |
 2015, Vol. 35
2015, Vol. 35