2. 郑州大学第一附属医院介入科
放射治疗是食管癌治疗的主要方法之一,但单纯放疗疗效较差,这与食管癌细胞的放射抗拒密切相关。环氧合酶(cyclooxygenase,Cox)[JP]是细胞代谢的主要限速酶。细胞水平证实,下调Cox-2表达可以提高食管癌EC9706细胞的辐射敏感性[1],但在活体水平是否如此仍需进一步验证。本研究通过构建裸鼠移植瘤模型观察调控Cox-2基因表达对食管癌EC9706细胞放射敏感性的影响,为Cox-2基因作为预测食管癌放疗疗效的评价指标提供实验依据。
1. 细胞系与主要试剂:人食管癌细胞系EC9706由郑州大学基础医学院病理生理学教研室提供;siRNA表达载体pRNA-U6.1、siRNA无关序列对照质粒(pRNAT-U6.1-Con)购自美国GenScript公司;真核表达载体pcDNA®4/HisMax C 购自美国Invitrogen公司。
2. 实验动物与分组:SPF级纯品系BALB/c雄性裸小鼠25只(北京维通利华实验动物技术有限公司),4~6周龄,体重15.2~18.5 g。动物合格证号:SCXK(京)2011-0006。细胞共分5组:Cox-2上调组、Cox-2下调组、无关siRNA对照组、载体对照组、空白对照组。Cox-2上调组为转染pcDNA®4-Cox-2的EC9706细胞,Cox-2下调组为稳定转染pRNA-U6.1-sicox214的EC9706细胞,无关siRNA对照组为稳定转染pRNA-U6.1-Con的EC9706细胞;载体对照组为稳定转染pcDNA®4/HisMax C的EC9706细胞。空白对照组为未经转染的EC9706细胞。裸鼠依据随机数字表分5组,每组5只,分别接种稳定转染的Cox-2上调组、Cox-2下调组、无关siRNA对照组、载体对照组、空白对照组细胞。
3. RT-PCR检测各组细胞Cox-2 mRNA的表达:用德国Qiagen公司的小量总RNA提取试剂盒提取各组细胞的mRNA,采用TaqMan探针荧光检测法,以β-肌动蛋白为内参照,分别检测细胞Cox-2 mRNA表达水平。Cox-2的引物和探针序列上游为5′ AATTCCAGTACCAAAATCGTATTGC 3′,下游为5′ ACTGTTGATAGTTGTATTTCTGGTCATGA 3′,探针为FAM-5′ TTTAACACCCTCTATCACTGGCATCCCCTT-TAMMR 3′。
4. Western blot检测蛋白表达:参照文献[2]方法,收集各组细胞,制备细胞总蛋白进行十二烷硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳。用电转移的方法将蛋白质转移到硝酸纤维素膜上,以Cox-2蛋白抗体为一抗,辣根过氧化物酶标记的山羊抗鼠IgG抗体为二抗检测Cox-2蛋白的表达。
5. 建立EC9706细胞系裸鼠移植瘤模型:分别在裸鼠的颈部皮下注射0.2 ml各组稳定转染的EC9706细胞悬液。隔天观察裸鼠的成瘤情况,注射后15 d,用游标卡尺测量肿瘤的长短径,并记录。
6. 裸鼠照射:接种3周后开始照射。使用专用小鼠体位固定架固定四肢和头部,使用德国西门子直线加速器6 MV X射线,照射野2 cm×2 cm,源皮距(SSD) 100 cm,吸收剂量率200 cGy/min,2 Gy/次,1次/d,5次/周,总剂量20 Gy。瘤体表面垫2 cm的固体水作为补偿,以提高瘤体的百分深度剂量。
7. 观察肿瘤放疗反应:照射期间隔天观察皮下移植瘤的放疗反应。照射结束后3 d处死裸鼠,剥取肿瘤,光电天平称重(G),按下列公式计算肿瘤体积(V)和抑瘤率:肿瘤体积=L(长径)×l(短径)2×0.52[3];抑瘤率(%)=(V对照组-V实验组)/V对照组×100%,[JP]或抑瘤率(%)=(G对照组-G实验组)/G对照组×100%。
8. 统计学处理:数据用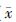 ±s表示。采用SPSS 13.0软件进行分析,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
±s表示。采用SPSS 13.0软件进行分析,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
1. Cox-2 siRNA载体构建结果:si214-F和si214-R发卡样DNA寡核苷酸单链,退火形成的DNA双链产物电泳可见明亮条带,位于接近100 bp处,与设计一致(图1);退火产物与线性双黏siRNA载体pRNA-U6.1连接,转化后得到多个阳性转化菌,随机选取1株提取质粒,对插入序列测序,结果与设计序列完全一致,得到pRNA-U6.1-sicox214。
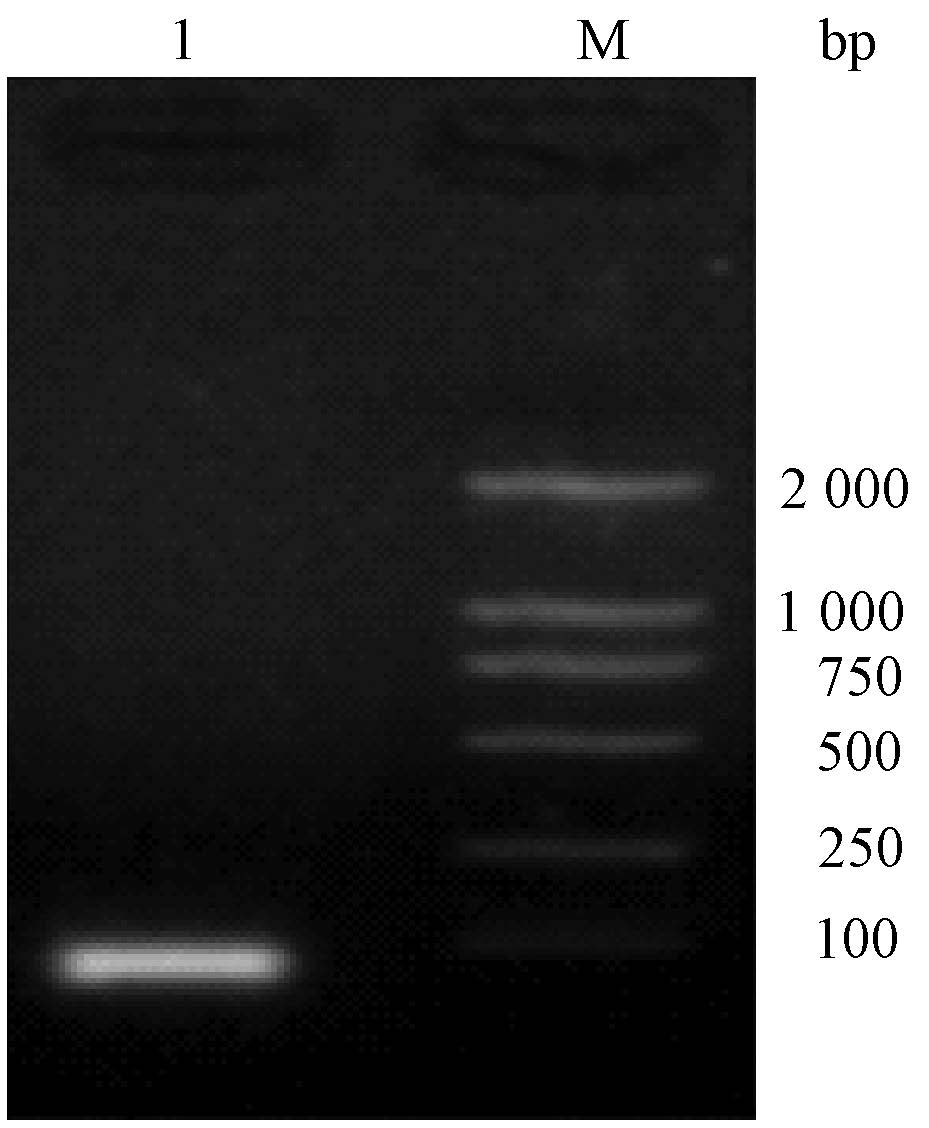
|
图1 针对Cox-2基因siRNA发卡DNA的退火电泳结果 注:1.si214-F和si214-R发卡样单链DNA退火产物;M.Marker |
2. Cox-2表达载体的构建结果:PCR扩增产物电泳,256 nm紫外灯下观察,可见1 815 bp的条带,与Cox-2基因ORF长度一致(图2)。将重组子pcDNA®4-Cox-2的测得序列用生物学软件与GenBank中Cox-2序列进行同源性比较分析,结果显示插入序列与GenBank中Cox-2序列完全一致。
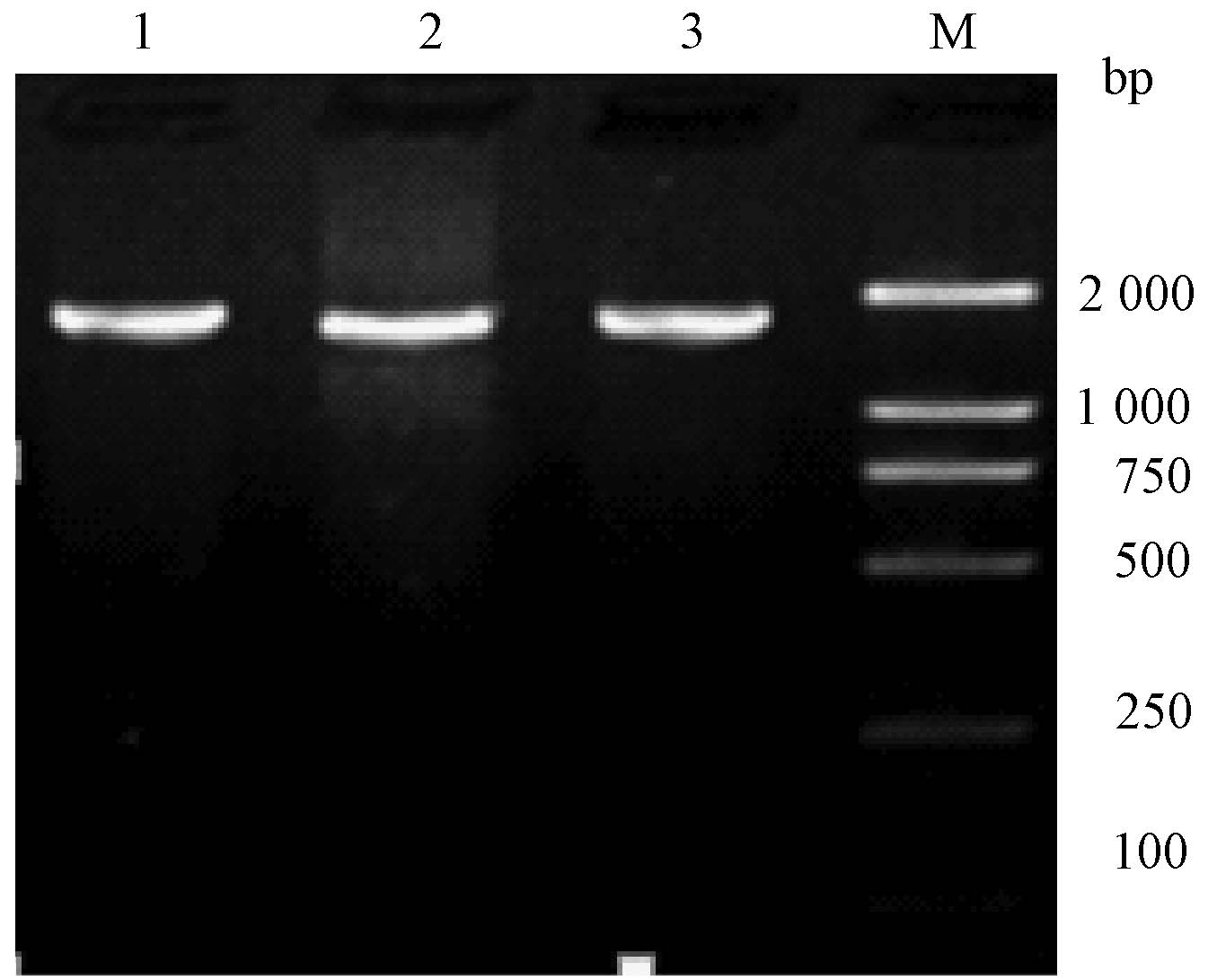
|
图2 Cox-2表达载体的PCR扩增产物电泳结果 注:1.目的基因Cox-2的PCR扩增条带;2、3均为 重组子pcDNA®4-Cox-2的扩增条带;M.Marker |
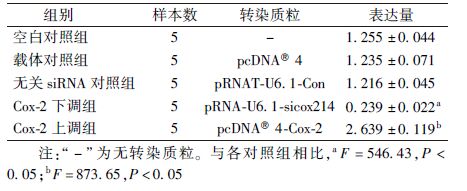
3. RT-PCR检测结果:结果列于表1。由表1可知,空白对照组与无关siRNA对照组、载体对照组细胞Cox-2 mRNA相对表达量比较,差异无统计学意义。Cox-2下调组与各对照组相比显著降低(F=546.43,P<0.05),说明构建的siRNA载体转染EC9706细胞后,能抑制细胞Cox-2 mRNA的表达;Cox-2上调组与各对照组相比显著升高(F=873.65,P<0.05),说明构建Cox-2表达载体转染EC9706细胞后,能高效表达Cox-2 mRNA。
表1 RT-PCR检测各组细胞Cox-2 mRNA相对表达量( ±s) ±s)
|
4. Western blot检测:空白对照组、无关siRNA对照组、载体对照组细胞均有较强的Cox-2免疫印迹条带;Cox-2下调组免疫印迹条带显著减弱,Cox-2上调组免疫印迹最强(图3)。说明构建Cox-2表达载体转染EC9706细胞后,能高效表达Cox-2 mRNA和蛋白。

|
图3 Western blot检测各组细胞Cox-2蛋白表达结果 注:1.Cox-2下调组;2.无关siRNA对照组;3.Cox-2上调组;4.载体对照组;5.空白对照组 |
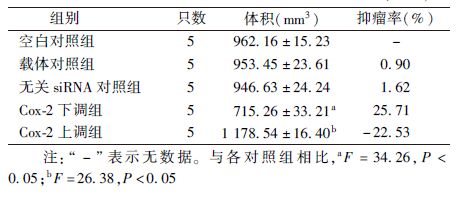
5. 皮下种植瘤的生长情况:接种后1周,裸鼠颈部皮下见新生肿瘤结节,2~3周时增至(5~10)mm×(5~10)mm,不同组别荷瘤小鼠肿瘤结节大小有差异。25只裸鼠皮下种植肿瘤成瘤率为100%,无自然死亡,各组之间成瘤率无明显差异。接种后3周,测量瘤体的长径和短径,结果列于表2。由表2可知,与空白对照组、siRNA对照组及载体对照组相比,Cox-2下调组裸鼠皮下种植瘤平均体积偏小(F=34.26,P<0.05);而Cox-2上调组裸鼠皮下种植瘤平均体积明显偏大,差异有统计学意义(F=26.38,P<0.05)。
表2 接种3周后不同处理组间皮下种植瘤体积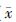
|
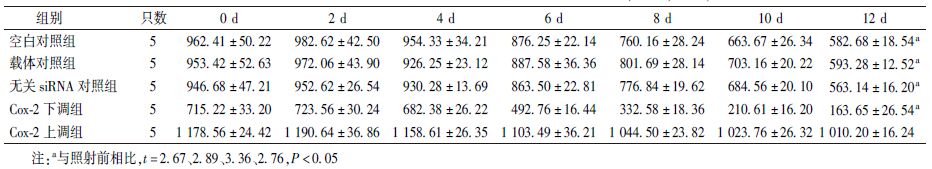
观察裸鼠的照射反应发现,吸收剂量为2~4 Gy时,皮下种植瘤明显增大,考虑为照射后局部组织水肿所致。随后,随着照射剂量的增加,肿瘤缩小明显。照射结束解剖裸鼠可见肿瘤组织为灰白色或淡红色,表面呈结节状,触及质地较硬。照射结束测量瘤体的长径和短径,结果列于表3。由表3可知,空白对照组、载体对照组、无关siRNA对照组和Cox-2下调组瘤体平均体积较照射前均减小(t=2.67、2.89、3.36、2.76,P<0.05),其中Cox-2下调组减小最为明显(F=16.35,P<0.05),而Cox-2上调组裸小鼠皮下种植瘤平均体积较照射前无明显变化。
表3 各组移植瘤开始照射后不同时间平均体积的变化(mm3,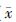 ±s) ±s)
|
6. 各实验组裸鼠移植瘤剥离后称重:Cox-2下调组、空白对照组、无关siRNA对照组和载体对照组瘤体质量分别为(0.612±0.061)、(0.997±0.045)、(1.007±0.092)和(1.015±0.087)g,Cox-2下调组与其他对照组比较,显著减低(F=6.89,P<0.05);Cox-2上调组瘤体质量为(1.314±0.105)g,与其他对照组相比,明显增高(F=17.53,P<0.05)。
Cox是前列腺素合成过程中一个主要限速酶,参与多种疾病的病理生理过程。相关研究显示,Cox-2在食管癌等多种肿瘤组织中呈高表达,参与肿瘤的发生、发展,且与恶性肿瘤的侵袭转移相关性密切[4, 5]。有研究提示,Cox-2可通过参与致癌物代谢,引起细胞增殖和凋亡失衡,促进肿瘤血管生成,增加肿瘤的浸润和转移能力[6],使机体免疫功能受到抑制[7]。
本实验通过观察食管癌EC9706细胞裸鼠移植瘤模型生长情况,发现25只裸鼠皮下种植肿瘤成瘤率为100%,无自然死亡,各组之间成瘤率差异无统计学意义,提示转染Cox-2 siRNA并没有影响食管癌EC9706细胞的成瘤性。此外,Cox-2下调组裸鼠皮下种植瘤平均体积与对照组相比较小,而Cox-2上调组裸鼠皮下种植瘤平均体积明显大于对照组。由此证实Cox-2高表达时肿瘤的生长及侵袭能力较强,肿瘤生长较快,Cox-2低表达时肿瘤的生长及侵袭能力相对较弱,肿瘤生长相对缓慢。Cox-2表达水平可作为评估肿瘤对放疗是否抵抗的一个指标[8, 9]。如在脑胶质细胞瘤中,放射抗拒的细胞中Cox-2表达水平是放射敏感者的1.7倍[6],放射抗拒性越强,Cox-2在肿瘤组织中的表达水平越高[8, 10]。研究表明,下调Cox-2表达可以提高肿瘤细胞放射敏感性,其机制可能是下调细胞内Cox-2表达,继而下调MMP2和Bcl-2,上调Bax表达,导致肿瘤细胞的侵袭及转移能力降低,诱导细胞凋亡[1]。为观察调控Cox-2基因表达对食管癌放疗敏感性的影响,本实验以瘤体放疗前后体积的变化和放疗后瘤体质量作为评价指标,结果显示,Cox-2下调组瘤体体积减小幅度明显高于空白对照组、载体对照组、无关siRNA对照组。而Cox-2上调组瘤体体积减小幅度明显低于对照组。放疗后Cox-2下调组瘤体质量明显低于空白对照组、载体对照组、以及无关siRNA对照组,Cox-2上调组瘤体质量明显高于对照组,说明下调Cox-2表达确实对食管癌移植瘤具有放射增敏作用,而上调Cox-2表达则使肿瘤放射抗拒。
由此认为,下调Cox-2基因表达与X射线照射联合治疗具有协同增强的抗肿瘤作用,抑制了肿瘤细胞对放射损伤的修复能力,从而增加了肿瘤对放射线的敏感性。因此,低表达Cox-2的肿瘤放射治疗效果较好,而高表达Cox-2的肿瘤则会放射抗拒,放射治疗效果较差。
| [1] | 卢晓旭, 吴慧, 徐靖, 等. Cox-2基因表达与食管癌细胞放射敏感性机制的初步探讨[J]. 中华放射医学与防护杂志,2015,35(7):496-500. |
| [2] | Pomares C, Despierres L, Delaunay P, et al. Western blot analysis as an aid for the diagnosis of cutaneous leishmaniasis due to Leishmania major[J]. Trans R Soc Trop Med Hyg, 2012, 106(7):452-454. |
| [3] | Reich SJ, Fosnot J, Kuroki A, et al. Small interfering RNA(siRNA)targeting VEGF effectively inhibits ocular neovascularization in a mouse model[J]. Mol Vis, 2003, 30(9):210-216. |
| [4] | Gomes TS, Noguti J, Forones NM, et al. Correlation analysis of c-myc, p21WAF/CIP1, p53, C-erbB-2 and COX-2 proteins in esophageal squamous cell carcinoma[J]. Pathol Res Pract, 2013, 209(1):6-9. |
| [5] | Shimizu S, Kuramochi K, Uchida K, et al. Increasing cyclooxygenase-2 (Cox-2) gene expression in progression of Barrett's esophagus to adenocarcinoma correlates with that of Bcl-2[J]. Int J Cancer, 2006, 119(4):765-770. |
| [6] | Mangon M, Bisanzis S, Carozzi F, et al. Association between genetic polymorphisms in the XRCC1, XRCC3, XPD, GSTM1, GSTT1, MSH2, MLH1, MSH3, and MGMT genes and radiosensitivity in breast cancer patients[J]. Int J Radiat Oncol, 2011, 81(1): 52-58. |
| [7] | Encheva E, Deleva S, Hristova R, et al. Investigating micronucleus assay applicability for prediction of normal tissue intrinsic radiosensitivity in gynecological cancer patients[J]. Rep Pract Oncol Radiother, 2012, 17(1): 24-31. |
| [8] | Ahn J, Urist M, Prives C. The CHK2 protein kinase[J]. DNA Repair (Amst), 2004, 3 (8-9): 1039-1047. |
| [9] | Saleem SZ, Lansdell JJ, Tepe JJ, et al. Synthesis and evaluation of debromohymenialdisine-derived Chk2 inhibitors[J]. Bioorg Med Chem, 2012, 20(4):1474-1481. |
| [10] | Gatei M, Sloper K, Sorensen C, et al. Ataxia-telangiectasia-mutated (ATM) and NBS1-dependent phosphorylation of CHK1 on Ser-317 in response to ionizing radiation [J]. Biol Chem, 2003, 278(17): 14806-14811. |
 2015, Vol. 35
2015, Vol. 35