2. 吉林大学第一医院;
3. 佳木斯大学附属第一医院
细胞因子是免疫细胞与基质细胞之间对话交流的媒介。辅助性T 细胞17(Th17)是新发现的一种T淋巴细胞亚群,参与先天性免疫和获得性免疫反应,其主要通过分泌IL-17细胞因子诱导白介素6(IL-6)、肿瘤坏死因子α(TNF-α)等多种炎症因子高表达,被认为是一群重要的介导炎症反应的细胞[1, 2, 3]。转化生长因子β(TGF-β)、IL-6、IL-23及IL-21在Th17细胞的分化形成过程中起着积极的促进作用。因此,研究不同剂量电离辐射对小鼠免疫细胞Th17细胞相关细胞因子的影响,有助于阐明高、低剂量电离辐射诱导的免疫功能机制。本实验通过检测高、低剂量辐射全身照射的小鼠胸腺细胞IL-17a与IL-21的分泌量的时间-效应和剂量-效应变化,探讨高、低剂量辐射诱导的免疫效应中Th17细胞功能。
1. 实验动物:健康ICR小鼠雌、雄各半,体重18~22 g,购于吉林大学基础医学院实验动物中心,许可证编号SCXK(吉)2013-0001。在时间-效应实验中,将ICR小鼠按随机数字表法分为健康对照组、低剂量照射组(0.075 Gy)和高剂量照射组(2.0 Gy),低剂量照射组和高剂量照射组又分别分为12、24、48 h组,每组6只,于照射后12、24、48 h断头处死小鼠取胸腺组织;在剂量-效应实验中,将ICR小鼠按随机数字表法分为健康对照组、0.05、0.075、0.5、1.0、2.0、4.0 Gy组,每组6只,于照后24 h断头处死小鼠取胸腺组织。
2. 照射条件:国产X.S.S.205(FZ)型固定式X射线深部治疗机(辽宁丹东市康嘉仪器设备有限公司),单次剂量0.5~4.0 Gy,源靶距60 cm,吸收剂量率0.343 Gy/min;单次剂量0.05~0.075 Gy,源靶距178.50 cm,吸收剂量率11.9 mGy/min。
3. 样品处理:取每只小鼠的胸腺组织1 g,在冷生理盐水中漂洗,除去血液,滤纸拭干,放入10 ml的小烧杯中,用移液管量取预冷的0.86%生理盐水,溶剂体积比为1∶9,尽快剪碎组织块,用玻璃匀浆器进行粉碎,取10%匀浆用低温离心机1 500 r/min,离心半径11.5 cm,离心10~15 min后,留取上清-80℃保存备用。
4. IL-17a与IL-21分泌量的检测:按照ELISA试剂盒操作方法(鼠IL-17a和IL-21购于美国Biotechnology公司),取组织匀浆上清液100 μl加入到平底酶标板中,每组设有3个平行样,用ELx800自动酶联免疫标记仪(美国BioTek公司),450 nm处检测吸光度(A)值。根据标准品绘制标准曲线,求出所测样品的相应浓度。
5. 统计学处理:数据以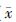 ±s表示,采用SPSS 17.0软件进行分析。IL-17a与IL-21分泌量数据进行ANOVA方差分析和独立样本t检验。P<0.05为差异有统计学意义。
±s表示,采用SPSS 17.0软件进行分析。IL-17a与IL-21分泌量数据进行ANOVA方差分析和独立样本t检验。P<0.05为差异有统计学意义。
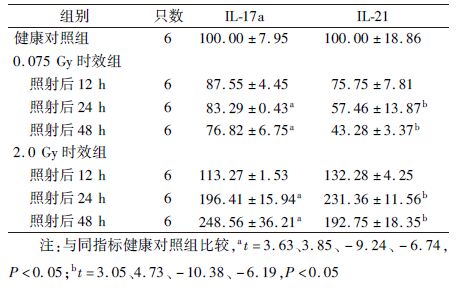
1. 小鼠胸腺细胞IL-17a和IL-21分泌量的时-效变化:X射线照射不同时间后小鼠胸腺细胞两种细胞相关因子表达的时-效变化结果列于表1。由表1可知,与健康对照组相比,0.075 Gy X射线照射后IL-17a的分泌量呈下降趋势,并于48 h降至最低(t=3.85,P<0.05);而在2.0 Gy X射线照射后其分泌量随时间逐渐增多,至48 h达最高(t=-6.74,P<0.05)。0.075 Gy X射线照射后IL-21的分泌量呈下降趋势,并于48 h降至最低(t=4.73,P<0.05);而在2.0 Gy照射后分泌量随时间上升,并于24 h达到最高水平,到48 h后仍处于高水平(t=-10.38、-6.19,P<0.05)。
表1 X射线照射不同时间后小鼠胸腺细胞IL-17a和
IL-21表达的时-效变化(%,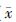 ±s) ±s)
|
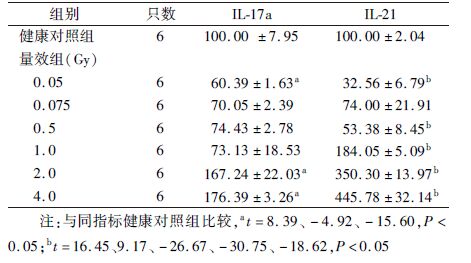
2. 小鼠胸腺分泌IL-17a与IL-21浓度的量-效变化: X射线不同剂量照射后小鼠胸腺细胞两种细胞相关因子表达的量-效变化结果列于表2。由表2可知,与健康对照组相比,低剂量(0.05和0.075 Gy)全身照射后,胸腺中IL-17a的表达均降低,在0.05 Gy时达到最低(t=8.39,P<0.05);而较高剂量(0.5、1、2和4 Gy)全身照射后IL-17a的表达呈剂量依赖性上升趋势,于4.0 Gy时达峰值(t=-15.60,P<0.05)。IL-21表达的量-效变化与IL-17a的趋势相近,在0.05 Gy降至最低(t=16.45,P<0.05);而较高剂量全身照射后逐渐呈剂量依赖性上升趋势,并于4.0 Gy处升至最高(t=-18.62,P<0.05),超过健康对照组水平的4.5倍。
表2 X射线不同剂量照射后小鼠胸腺细胞IL-17a与
IL-21表达的量-效变化(%,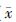 ±s) ±s)
|
近代免疫学理论认为,根据细胞的分化和功能将CD4+T细胞分为1型和2型辅助性T细胞(Th)和调节性T细胞(Treg)[4]。2005年发现新型效应性Th细胞亚群—Th17细胞,发现Th17细胞由TGF-β、IL-1、IL-6、IL-21、IL-23所诱导,并分泌大量的IL-17a、IL-17f、和IL-22,在组织炎症和自身免疫疾病发生的过程中起到重要作用。
IL-17是一种由活化的T细胞产生的致炎细胞因子,可以促进T细胞的激活并刺激上皮细胞、内皮细胞、成纤维细胞产生多种细胞因子,从而导致炎症的产生[5, 6]。Th17的分化通过TGF-β和IL-6的共同作用来启动;新分化的Th17细胞通过其分泌的IL-21促进Th17的扩增,最后,Th17细胞特征的稳定和维持是通过IL-23实现的。IL-6是一个致炎性因子,感染或局部炎症能产生大量的IL-6和TGF-β,可抑制巨噬细胞和淋巴细胞等细胞的免疫功能,发挥免疫负调控作用,从而能够维持免疫耐受的稳定状态[7]。本实验中,较高剂量辐射诱导的IL-17a增多,其变化出现时间和剂量依赖现象,可能与TGF-β分泌增多有关,高剂量电离辐射可使小鼠免疫细胞TGF-β的表达量上升[8],可能在TGF-β和IL-6 的共同诱导下分化为Th17[9],使IL-6和IL-17的表达量升高,进而影响机体免疫功能。而低剂量电离辐射可以使负性调节因子TGF-β的表达量呈下降趋势[10],并且使正向调节因子γ干扰素(IFN-γ)呈上升趋势[11],从而使IL-17a分泌量显著下降,提示正向调节的细胞因子分泌的增加和负性调节因子的下降,可能是低剂量辐射兴奋效应的主要原因之一。已有研究发现,IFN-γ可通过抑制TGF-β下游信号转导因子Smad3磷酸化,从而阻断Smad3对TGF-β受体的作用,进而干扰TGF-β诱导Th17细胞分化的过程,导致IL-17的分泌量降低,从而发挥免疫效应[12]。
IL-21是IL-2家族成员,由Th17细胞大量分泌,IL-21与TGF-β协同促进Th17细胞的分化。Bettelli等[13]发现,在IL-6缺陷的条件下,TGF-β和IL-21共存可促进CD4+T细胞分化为Th17细胞,并释放IL-21。进一步研究发现,在Th1、Th2细胞IL-21的分泌水平较低,而在Th17细胞IL-21则相反。本实验结果显示,较高剂量照射后小鼠胸腺细胞IL-21分泌量增加,可能在与TGF-β的共同作用下,导致IL-17a的分泌量增加,从而参与诱导机体免疫功能的下降;相反,低剂量辐射对小鼠胸腺细胞分泌IL-21有抑制作用,因为IL-21是Th17的驱动因子,所以低剂量辐射可以抑制Th17的分化形成,从而降低IL-17a的表达。文献报道,较高剂量辐射可以诱导小鼠免疫细胞TGF-β的表达量上升[10],幼稚Th细胞在TGF-β存在的情况下趋向于表达转录因子Foxp3,从而分化为Treg细胞。在TGF-β和IL-21共同存在的情况下,能抑制TGF-β诱导的Foxp3的表达,从而阻止Treg细胞的分化,使得幼稚T细胞向Th17细胞分化。单独的TGF-β或者IL-21均不能使幼稚T细胞大量产生IL-17a,只有两者同时作用才能引起IL-17a的大量分泌。本实验结果提示,较高剂量电离辐射可能通过增强TGF-β和IL-21的分泌量,共同促进Th17细胞的分化,从而诱导IL-17a的分泌,在抑制机体免疫功能中发挥重要作用。
综上所述,胸腺细胞受到高、低剂量电离辐射作用后,Th17细胞相关的细胞因子IL-17a和IL-21分泌量的变化完全相反,主要表现为低剂量照射后降低,而较高剂量照射后升高,从而为阐明辐射免疫学理论提供理论依据。
| [1] | Chen O, Zhu X, Ren H, et al. The imbalance of Th17/Treg in Chinese children with Henoch-Schonlein purpura[J]. Int Immunopharmacol, 2013, 16(1): 67-71. |
| [2] | Nurieva R, Yang XO, Martinez G, et al. Essential autocrine regulation by IL-21 in the generation of inflammatory T cells[J]. Nature, 2007, 448(7152): 480-483. |
| [3] | Zheng Y, Danilenko DM, Valdez P, et al. Interleukin-22, a TH17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis[J]. Nature, 2007, 445(7128): 648-651. |
| [4] | Moore-Connors JM, Fraser R, Halperin SA, et al. CD4+ CD25+ Foxp3+ regulatory T cells promote Th17 responses and genital tract inflammation upon intracellular chlamydia muridarum infection[J]. J Immunol, 2013, 191(6): 3430-3439. |
| [5] | Komiyama Y, Nakae S, Matsuki T, et al. IL-17 plays an important role in the development of experimental autoimmune encephalomyelitis[J]. J Immunol, 2006, 177(1): 566-573. |
| [6] | Chen WS, Chang YS, Lin KC, et al. Association of serum interleukin-17 and interleukin-23 levels with disease activity in Chinese patients with ankylosing spondylitis[J]. J Chin Med Assoc, 2012, 75(7): 303-308. |
| [7] | 陈俊伟, 张少然, 闫成兰, 等. T辅助细胞亚型细胞相关因子在类风湿关节炎发病中的作用[J]. 中国药物与临床, 2012, 12(4): 420-423. |
| [8] | Dong JC, Cheng GH, Shan YX, et al. Role of PLC-PIP2 and cAMP-PKA signal pathways in radiation-induced immune-suppressing effect[J]. Biomed Environ Sci, 2014, 27(1): 27-34. |
| [9] | Maddur MS, Miossec P, Kaveri SV, et al. Th17 cells: biology, pathogenesis of autoimmune and inflammatory diseases, and therapeutic strategies[J]. Am J Pathol, 2012, 181(1): 8-18. |
| [10] | 孟凡旭, 单玉兴, 董娟聪, 等. 不同剂量电离辐射对小鼠脾脏调节性T细胞及TGF-β1表达的影响[J]. 吉林大学学报: 医学版, 2011, 37(3): 398-402. |
| [11] | 李修义, 陈玉丙,夏凤琴,等. 低剂量辐射对小鼠移植肿瘤生长和肿瘤诱生的影响[J]. 中国辐射卫生, 1996, 5(1):21-23. |
| [12] | McKarns SC, Schwartz RH. Distinct effects of TGF-β1 on CD4+ and CD8+ T cell survival, division, and IL-2 production: a role for T cell intrinsic Smad3[J]. J Immunol, 2005, 174(4): 2071-2083. |
| [13] | Bettelli E, Korn T, Kuchroo VK. Th17: the third member of the effector T cell trilogy[J]. Curr Opin Immunol, 2007, 19(6): 652-657. |
 2015, Vol. 35
2015, Vol. 35