2. 军事医学科学院放射与辐射医学研究所
机体细胞受到电离辐射后,产生大量活性氧(reactive oxygen species,ROS),引起氧化应激(oxidative stress),导致DNA突变、细胞凋亡、周期阻滞等,使细胞受到氧化损伤、活力降低。抗氧化是对抗电离辐射的一种重要策略,核转录因子红细胞系-2(NF-E2)p45相关因子-2(nuclear factor-erythroid 2 p45-related factor 2,Nrf2)-Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)-抗氧化反应元件(antioxidant response elements,ARE)信号通路是调控细胞抗氧化能力的重要通路。因此,针对电离辐射所致氧化损伤及其对Nrf2-Keap1-ARE抗氧化信号通路影响的研究对辐射防护与治疗具有重要意义。
四物汤,记载于宋代《太平惠民和剂局方》,由熟地黄、当归、白芍、川芎4味药材组成,具有补血和血,调经化瘀的功效,可有效地抑制电离辐射引起的造血损伤和外周血细胞减少[1, 2, 3, 4, 5]。四物汤中的单体有效成分,如阿魏酸、芍药苷等,可通过抗氧化作用防护电离辐射引起的细胞损伤[6, 7, 8, 9, 10]。然而,中药复方具有多成分、多途径、多靶点起效的特点,单一物质难以全面地反映复方的整体作用。四物汤化学成分组合与原方作用相似,可促进骨髓基质细胞增殖和造血相关基因的表达[4],但其对辐射损伤的作用尚未详细阐明。故参考以上单体及组合的研究,分别选取熟地黄、当归、芍药、川芎中的主要有效抗辐射成分果糖、阿魏酸、芍药苷、盐酸川芎嗪(质量比为9 008∶53∶721∶267)组成四物汤有效成分配伍组方替代原方,考察其对电离辐射所致氧化损伤的作用及其对Nrf2-Keap1-ARE抗氧化通路的作用。
1. 实验细胞与培养体系:人淋巴母细胞AHH-1细胞系,为本实验室保存细胞系;培养于RPMI 1640培养液(含10%马血清),37℃、5%CO2孵箱,悬浮成簇生长,每2天更换培养液、传代。人胚肾细胞HEK 293细胞系,为本实验室保存细胞系;培养于DMEM培养液(含10%胎牛血清),37℃、5%CO2孵箱,贴壁单层生长,布满培养瓶底面80%左右时传代,每2天更换培养液。
2. 仪器设备:钴源(军事医学科学院放射与辐射医学研究所),Cytomics FC 500全自动流式细胞分析仪(美国Beckman Coulter公司)。
3. 实验药品与试剂:果糖购自美国Sigma公司。阿魏酸、芍药苷、盐酸川芎嗪均购自中国食品药品检定研究院。RPMI 1640干粉培养基、马血清、胎牛血清,均购自美国GIBCO公司。CellTiter96®AQueous单溶液试剂(MTS),Dual-Luciferase® Reporter Assay System,均购自美国Promega公司。Annexin V-FITC凋亡检测试剂盒,购自北京宝赛生物技术有限公司。活性氧检测试剂盒C1300,购自北京普利莱基因技术有限公司。LipofectamineTM 2000购自美国Invitrogen公司。叔丁基对苯二酚(tBHQ)购自梯希爱(上海)化成工业发展有限公司。
4. 四物汤有效成分配伍组方配置:分别取果糖、阿魏酸、芍药苷、盐酸川芎嗪标准品,溶于RPMI 1640培养液中,配置成储存液。果糖储存液900.8 mg/L、阿魏酸储存液5.3 mg/L、芍药苷储存液72.1 mg/L、盐酸川芎嗪储存液26.7 mg/L。使用前,上述4种储存液各取100 μl混合于同一个1.5 ml离心管内,加入600 μl常规培养液,该混合液即为四物汤有效成分配伍组方的储存液,浓度为100 mg/L。按实验需要将四物汤有效成分配伍组方的储存液稀释成不同浓度作用于细胞。
5. MTS法检测细胞活力:96孔板每孔加入细胞密度为2.5×105/ml细胞悬液100 μl,分为正常组、照射模型组、0.01、0.1、1、10、100 mg/L 5个不同剂量的四物汤有效成分配伍组方处理组,每组4个复孔。照射前12 h,将不同浓度的四物汤有效成分配伍组方作用于细胞,正常组和照射模型组基于等体积的空白培养液。正常组做假照射,照射模型组及各给药组4.0 Gy 60Co γ射线单次照射,吸收剂量率1.71 Gy/min,源靶距4 m,照射后37℃、5%CO2培养箱箱孵育24 h,各孔加入10 μl MTS,孵育3 h后,于490 nm处测定吸光度(A)值,检测细胞活力改变。细胞活力(%)=(A待测-A空白)/(A正常对照-A空白)×100%。
6. 流式细胞术检测细胞凋亡:AHH-1细胞于25 cm2培养瓶中培养至密度约为2.5×105/ml,分为正常组、照射模型组、0.1、1、10 mg/L 3个不同剂量的四物汤有效成分配伍组方处理组,每组3瓶。照射前12 h将不同浓度的四物汤有效成分配伍组方作用于细胞。正常组做假照射,照射模型组及各给药组4.0 Gy 60Co γ射线单次照射,照射后37℃、5%CO2培养箱孵育6 h。检测细胞凋亡情况,操作步骤如下:①轻轻振荡,使细胞混匀,吸取4 ml,离心半径9.5 cm,1 000 r/min,4℃离心10 min,弃上清;②加入1 ml冷的PBS,轻轻振荡使细胞混匀;③离心半径9.5 cm,1 000 r/min,4℃离心10 min,弃上清;④重复步骤②、③两次;⑤将细胞重悬于200 μl 缓冲液中;⑥加入10 μl Annexin V-FITC轻轻混匀,避光室温反应15 min;⑦加入300 μl 缓冲液(总反应体积500 μl)以及5 μl PI,上机检测。
7. DCFH-DA荧光探针法检测细胞内ROS水平:96孔板分别加入细胞密度为2.5×105/ml 的AHH-1细胞悬液100 μl,分为正常组、照射模型组和0.1、1、10 mg/L 3个不同剂量的四物汤有效成分配伍组方处理组,每组4个复孔。照射前12 h,将不同浓度的四物汤有效成分配伍组方作用于细胞。正常组做假照射,模型组及各给药组4.0 Gy 60Co γ射线单次照射,照射后37℃、5%CO2培养箱孵育3 h,检测细胞ROS表达水平。操作步骤如下:①离心半径9.5 cm,1 000 r/min,离心10 min,弃上清;②加入100 μl冷的PBS,轻轻振荡,洗涤;③离心半径9.5 cm,1 000 r/min,离心10 min,弃上清;④加入100 μl冷的PBS,轻轻振荡,混匀;⑤加入DCFH-DA 10 μmol/L,37℃、5%CO2培养箱孵育30 min;⑥在VICTOR® X5 Multilabel Plate Reader上检测,激发波长490 nm,发射波长530 nm。ROS水平=待测样品ROS信号/正常组ROS信号平均值。
8. 双报告基因法检测Nrf2-Keap1-ARE信号通路的激活:参考文献[11]方法,用LipfectamineTM 2000将连入ARE特异序列的重组报告基因载体pGL4-ARE和pRL-TK同时瞬时转染到HEK 293细胞中。设空白对照组、阳性对照组和0.31、0.62、1.25、2.5、5、10 mg/L 6个不同浓度的四物汤有效成分配伍组方组,每组4个复孔。转染后6 h换液,空白对照组加入常规培养液,阳性对照组加入含50 μmol/L tBHQ的培养液,其他组按设定浓度加入含不同浓度的四物汤有效成分配伍组方培养液。孵育24 h后检测两种报告基因的信号强度。诱导表达倍数=(药物诱导组的pGL4-ARE信号强度/药物诱导组的pRL-TK信号强度)/(空白组的pGL4-ARE信号强度/空白组的pRL-TK信号强度)。
9. 统计学处理:所有计量资料均以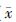 ±s表示,采用SPSS 13.0软件进行分析。各组数据进行正态性检验,实验结果近似符合正态分布;组间比较采用独立样本t检验分析。P<0.05为差异有统计学意义。
±s表示,采用SPSS 13.0软件进行分析。各组数据进行正态性检验,实验结果近似符合正态分布;组间比较采用独立样本t检验分析。P<0.05为差异有统计学意义。
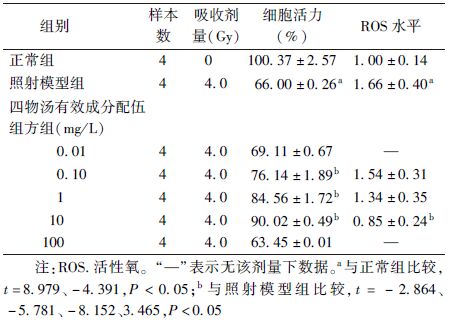
1. 四物汤有效成分配伍组方对细胞活力的影响:四物汤中4种主要的有效成分联合应用所组成的成分配伍组方,可以缓解4.0 Gy 60Co γ射线照射后的AHH-1细胞活力降低,并呈现出浓度依赖性。在四物汤有效成分配伍组方0.1~10 mg/L之间,细胞活力明显提高,与照射模型组比较,差异有统计学意义(t=-2.864、-5.781、-8.152,P<0.05),10 mg/L时抗辐射效果最为显著,可使受照AHH-1细胞的细胞活力由65%左右提升至90%左右。当药物浓度进一步升高时,细胞活力下降。故后续实验四物汤有效成分配伍组方的最高药物浓度设定为10 mg/L(表1)。
表1 四物汤有效成分配伍组方对4.0 Gy 60Co γ射线照射的AHH-1细胞活力及ROS水平影响( ±s) ±s)
|
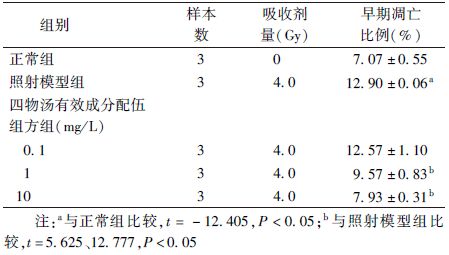
2. 四物汤有效成分配伍组方对细胞凋亡的影响:细胞流式分析结果表明,四物汤有效成分配伍组方可以缓解AHH-1细胞在4.0 Gy 60Co γ射线照射后的早期凋亡,且随剂量升高作用增强。10 mg/L的四物汤有效成分配伍组方,可将4.0 Gy 60Co γ射线照射的AHH-1细胞早期凋亡由12.90%降低至7.93%(t=12.777,P<0.05),接近平行处理正常组细胞的早期凋亡水平(图1、表2)。
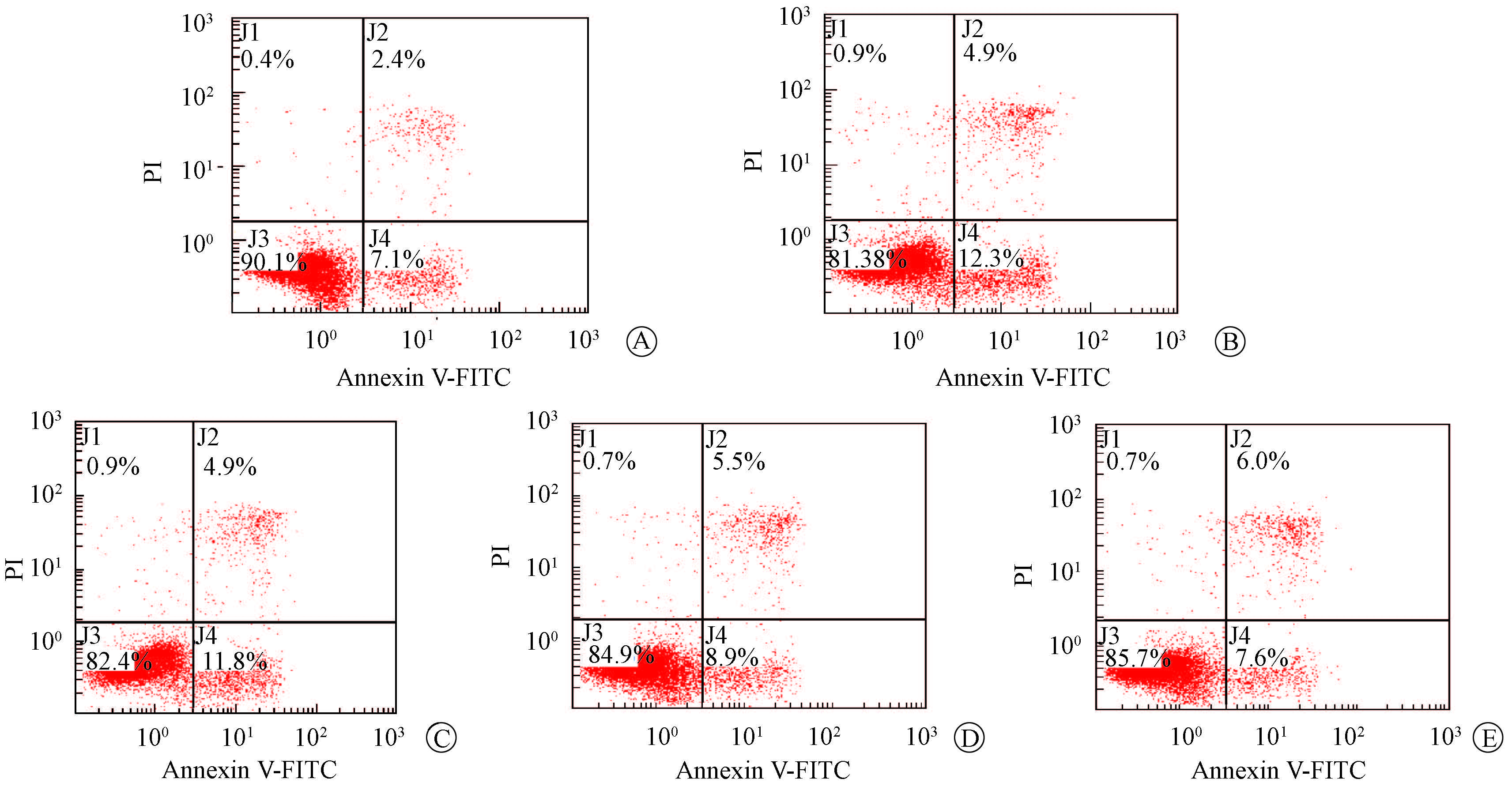
|
图1 四物汤有效成分配伍组方对4.0 Gy 60Co γ射线照射后AHH-1细胞早期凋亡影响 A.正常组; B.照射模型组;C~E分别为四物汤有效成分配伍组方0.1、1、10 mg/L组 注:J1. 坏死细胞区域;J2. 晚期凋亡细胞区域;J3. 正常细胞区域;J4. 早期凋亡细胞区域 |
表2 四物汤有效成分配伍组方对4.0 Gy 60Co γ射线照射AHH-1细胞早期凋亡的影响( ±s) ±s)
|
3. 四物汤有效成分配伍组方对细胞ROS表达水平的影响:4.0 Gy 60Co γ射线照射后AHH-1细胞内的ROS水平升高至正常细胞的1.66倍。四物汤有效成分配伍组方可降低4.0 Gy 60Co γ射线照射所致细胞内的ROS水平,且该作用随药物浓度升高而增强。在10 mg/L浓度下的四物汤有效成分配伍组方可将受照细胞内的ROS水平由正常细胞的1.66倍降至0.85倍,与照射模型组比较,差异有统计学意义(t=3.465,P<0.05),与正常组比较,差异无统计学意义(表1)。
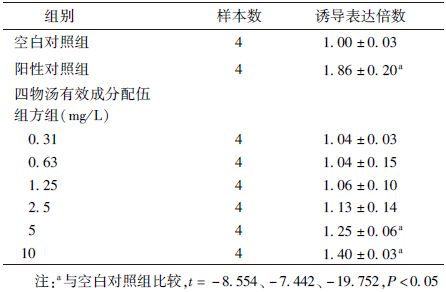
4. 四物汤有效成分配伍组方对Nrf2-Keap1-ARE信号通路的影响:5 mg/L及其以上浓度的四物汤有效成分配伍组方可以浓度依赖性的诱导pGL4-ARE报告基因载体激活,使其荧光诱导表达倍数升高,与空白组比较,差异有统计学意义(t=-7.442,P<0.05)。10 mg/L的四物汤有效成分配伍组方的作用最强,可将荧光诱导表达倍数提升至正常组的1.4倍左右(t=-19.752,P<0.05,表3)。
表3 四物汤有效成分配伍组方对pGL4-ARE重组报告基因载体的影响( ±s) ±s)
|
血液系统和免疫系统对电离辐射十分敏感。造血干细胞向淋巴系干/祖细胞分化后,一部分祖细胞可在骨髓造血微环境的诱导下增殖分化为B淋巴细胞,B淋巴细胞在骨髓中快速发育,成熟时穿越血窦进入血液循环,执行免疫功能[12]。AHH-1为人外周血B淋巴母细胞系,受照后快速发生细胞凋亡、周期阻滞、活力降低等反应,可以比较直观地反映出辐射对于免疫和血液系统的影响。四物汤有效成分配伍组方可以有效抑制4.0 Gy 60Co γ射线所引起的AHH-1细胞活力降低和细胞早期凋亡,且具有浓度依赖性;10 mg/L时其效果最佳;当四物汤有效成分配伍组方中各药物浓度继续增高时,受照细胞的活力反而降低,推测是由于药物浓度增大改变培养液环境及细胞渗透压所致。
ROS的能量传递是电离辐射直接/间接损伤细胞的重要方式之一,可以通过攻击生物磷脂膜诱发脂质过氧化作用[13]。机体受到电离辐射后,体内ROS大幅提高,引起抗氧化系统失衡,导致机体受到氧化损伤,进而发生细胞凋亡反应。因此,调节细胞抗氧化防御功能是对抗电离辐射的一种重要策略。Nrf2-Keap1-ARE信号通路是调控细胞氧化应激的重要通路,在辐射的应激反应中起着非常重要作用[14]。在抗氧化类药物的作用下,细胞质中Keap1与Nrf2解耦联,Nrf2转移入核,与核内的Maf蛋白结合后识别并结合ARE,受ARE调控的下游的保护性基因得以启动,相关抗氧化酶表达量增高,从而清除过量的ROS,缓解辐射引起的氧化损伤[11, 15, 16]。四物汤有效成分配伍组方可以有效地清除4.0 Gy 60Co γ射线照射后AHH-1细胞过量表达的ROS,使之向正常细胞水平恢复,从而缓解氧化损伤,减少细胞早期凋亡;同时,该组方可激活重组报告基因载体pGL4-ARE。因此推测,四物汤有效成分配伍组方抑制4.0 Gy 60Co γ射线所致氧化损伤的作用可能是通过激活Nrf2-Keap1-ARE信号通路,促进下游抗氧化保护基因表达而实现的。
综上,推测四物汤有效成分配伍组方可以通过激活Nrf2-Keap1-ARE信号通路、降低ROS水平发挥抗氧化作用,从而缓解外周血淋巴母细胞的早期凋亡,缓解细胞活力减低,实现对电离辐射所致氧化损伤的防护作用。组方中各有效成分对应原方中的君臣佐使关系及药物相互作用,还有待进一步分析。
| [1] | 马增春, 高月, 刘永学, 等. 四物汤对γ射线照射致血虚证小鼠造血细胞作用的研究[J].中国实验方剂学杂志, 2001, 7(3): 41-44. |
| [2] | 高月. 血虚证实质及四物汤反证研究[J].中国实验方剂学杂志, 2003, 9(4): 58-60. |
| [3] | 梁乾德, 路晓钦, 马增春, 等. 四物汤促进造血功能成分的初步研究[J]. 中国中药杂志, 2004, 29(6): 546-549. |
| [4] | 李鹰飞, 佟丽, 梁乾德, 等. 四物汤化学成分组合对人骨髓基质细胞系HFCL细胞增殖及造血相关基因表达的影响[J]. 中草药, 2005, 36(3): 386-389. |
| [5] | 王东根, 马增春, 邵帅, 等. 新型四物方补血活性部位的初步筛选[J]. 解放军药学学报, 2011, 27(2): 95-98. |
| [6] | Ma ZC, Hong Q, Wang YG, et al. Ferulic acid induces heme oxygenase-1 via Activation of ERK and Nrf2 [J]. Drug Discov Ther, 2011, 5(6): 299-305. |
| [7] | Ma ZC, Hong Q, Wang YG, et al. Ferulic acid attenuates adhesion molecule expression in gamma-radiated human umbilical vascular endothelial cells[J]. Biol Pharm Bull, 2010, 33(5): 752-758. |
| [8] | Ma ZC, Hong Q, Wang YG, et al. Ferulic acid protects lymphocytes from radiation-predisposed oxidative stress through extracellular regulated kinase[J]. Int J Radiat Biol, 2011, 87(2): 130-140. |
| [9] | Ma ZC, Hong Q, Wang YG, et al. Effects of ferulic acid on hematopoietic cell recovery in whole-body gamma irradiated mice[J]. Int J Radiat Biol, 2011, 87(5): 499-505. |
| [10] | Li CR, Zhou Z, Zhu D, et al. Protective effect of paeoniflorin on irradiation-induced cell damage involved in modulation of reactive oxygen species and the mitogen-activated protein kinases[J]. Int J Biochem Cell Biol, 2007, 39(2): 426-438. |
| [11] | 邵帅, 谭洪玲, 肖成荣, 等. 基于Nrf2-ARE通路的抗辐射有效活性成分筛选研究[J]. 中国药理学通报, 2012, 28(1): 29-33. |
| [12] | 王立生,陈家佩. 血细胞生成的生理学基础//陈家佩. 辐射血液学—基础与临床[M]. 北京:军事医学科学出版社, 2002:53. |
| [13] | 张铭. 电离辐射生物学作用的理化基础和基本规律//刘树铮. 医学放射生物学[M]. 3版. 北京:原子能出版社, 2010:13-15. |
| [14] | 梁莉, 阙琳玲, 曹宝山, 等. Nrf2在姜黄素保护UVB所致细胞氧化损伤中的作用[J]. 中华放射医学与防护杂志, 2014, 34(8):583-587. |
| [15] | McMahon M, Thomas N, Itoh K, et al. Dimerization of substrate adaptors can facilitate cullin-mediated ubiquitylation of proteins by a "tethering" mechanism: a two-site interaction model for the Nrf2-Keap1 complex[J]. J Biol Chem, 2006, 281(34):24756-24768. |
| [16] | 李航, 段惠军. Nrf2/ARE信号通路及其调控的抗氧化蛋白[J]. 中国药理学通报, 2011, 27(3):300-303. |
 2015, Vol. 35
2015, Vol. 35