肿瘤细胞内凋亡抑制蛋白家族(IAPs)的主要作用是通过与有活性的Caspase-3、Caspase-7和Caspase-9结合,继而阻碍它们的功能,最终抑制细胞的凋亡,使肿瘤细胞产生辐射耐受性。因此,在辐射耐受的肿瘤细胞中,凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)往往高表达[1]。Smac(second mitochondria-derived activator of Caspase,Smac)作为一种有效的促凋亡蛋白[2, 3],可以抑制凋亡抑制蛋白XIAP的功能,明显提高肿瘤细胞对化疗和放疗的敏感性。然而,Smac蛋白在辐射耐受的肿瘤细胞中往往是低表达的,且外源性的Smac蛋白无法顺利进入细胞。因此,功能性的Smac蛋白类似物成为近年来研究者探索的重点[4]。
研究表明,Smac促凋亡活性的功能基团定位于N端的7个氨基酸残基,即Smac N7[5, 6]。免疫荧光技术发现,Smac N7不能从细胞外进入细胞[7, 8],因此,本研究应用人类免疫缺陷病毒-iHIV-I的Tat (trans-activating transcriptional activator,Tat)蛋白中Tat9肽(49-57)作为引导肽[9],合成Tat-Smac N7融合肽,把Smac N7顺利导入肿瘤细胞,发挥其促凋亡活性。目前,研究最多的是Smac类似物提高肿瘤对化疗药物敏感性机制的研究[10],但其如何提高放疗耐受肿瘤的辐射敏感性机制研究并不多见。本研究拟初步探索Tat-Smac N7融合肽促进辐射诱导的细胞凋亡机制。
1. 材料和主要试剂:人食管癌细胞EC109和人肺癌细胞H460细胞系为天津放射医学研究所辐射损伤效应实验室保存。胰蛋白酶、乙二胺四乙酸(EDTA)裂解液购自美国GIBCO公司;水溶性四氮唑-1(WST-1)购自北京碧云天公司;Annexin V凋亡试剂盒购自美国BD生物科学公司;一抗购自英国Abcam公司;反转录试剂盒(Prime Script RT)购自大连宝生物工程有限公司;Ac-DEVD-AFC、Ac-IETD-AFC、Ac-LEHD-AFC购自美国BD公司;10%胎牛血清(FBS)购自美国GIBCO公司;RPMI 1640培养基购自美国GIBCO公司;正置荧光显微镜购自日本尼康公司;流式细胞仪购自美国Beckman公司。
2. 多肽合成以及多肽的细胞渗透试验:以Tat蛋白的Tat9肽作为引导肽,Smac N7作为功能肽,合成Tat-Smac N7融合肽(上海生工生物工程有限公司完成)。为了观察该融合蛋白是否具有细胞渗透的功能,在其羧基端用异硫氰酸荧光素(FITC)进行标记。取对数生长期人肺癌细胞系H460和食管癌细胞系EC109,分为DAPI对照组、FITC-Smac N7组、FITC-Tat-Smac N7组,用冰冷的PBS清洗2次,常规消化收集细胞。用含10%FBS的RPMI 1640制备细胞悬液,调整细胞浓度为1×105/ml。取200 μl滴加到置于6孔板中的载玻片中,24 h后待细胞贴壁,弃去培养液,加入Tat-Smac N7,浓度为20 μmol/L。继续培养3 h后,荧光显微镜观察两种细胞不同时间药物入核情况。
3. WST-1生长实验:将对数生长期的细胞,用胰酶消化后,用含10%胎牛血清的培养基配成浓度为2.5×104/ml的细胞悬液。接种在96孔培养板中,每孔200 μl细胞悬液,设5个平行孔。 经37℃、5%CO2条件下培养12 h待细胞贴壁。不同条件处理细胞后,到指定时间取出细胞,将孔内细胞培养基轻轻吸出,每孔加WST-1 20 μl,放入孵箱继续培养0.5~4 h。在多功能酶标仪上用450 nm波长测定吸光度(A)值。 根据吸光度(A)值计算细胞存活率。细胞存活率=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)×100%。
4. Annexin V-PITC/PI双染法测定细胞凋亡:细胞用不含EDTA的胰酶消化收集;用PBS洗涤细胞2次,离心半径5 cm,1 500 r/min离心5 min,收集5×105细胞;加入500 μl的结合缓冲液(Binding Buffer)悬浮细胞;加入5 μl Annexin V-FITC混匀后,加入5 μl碘化丙啶(PI),混匀;室温、避光、反应5~15 min;在1 h内,进行流式细胞仪的观察和检测。激发波长Ex=488 nm,发射波长Em=530 nm。Annexin V-FITC的绿色荧光通过FITC通道(FL1)检测;PI红色荧光通过PI通道(FL2或FL3)检测。
5. 统计学处理:结果用x±s表示。采用SPSS 13.0软件进行分析。组间差异用析因设计的方差分析,计数资料的比较采用χ2检验。P<0.05为差异有统计学意义。
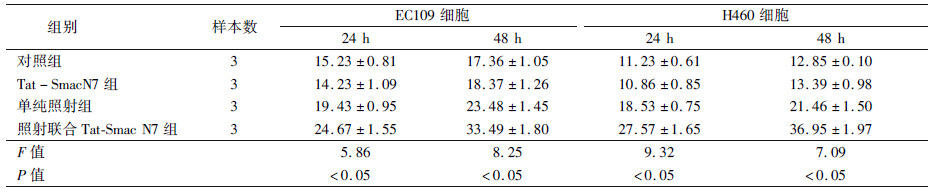
1. Tat-Smac N7融合肽进入细胞的能力:为确定Tat-Smac N7能否进入细胞,实验分别观察了Smac N7、Tat-Smac N7进入EC109和H460细胞后2和24 h的FITC荧光强度。用DAPI溶液染色作为对照组,确定细胞核的位置,结果表明,Tat-Smac N7融合蛋白进入2种细胞后2 h可以有蓄积,且这种蓄积可延续到24 h,而Smac N7则不能进入细胞,见图 1。
 | 注:DAPI着色(蓝色)的细胞为活细胞,FITC着色(绿色)的细胞为多肽进入的细胞;a. DAPI对照组(FITC-Smac N7组细胞核定位);b. FITC-Smac N7组;c. DAPI对照组(FITC-Tat-Smac N7组细胞核定位);d. FITC-Tat-Smac N7组图 1 Smac N7和Tat-Smac N7不同时间对不同细胞的穿透性比较 |
2.Tat-Smac N7对细胞的毒性实验:为了观察Tat-Smac N7对两种细胞有无毒性作用,采用WST-1试验,EC109和H460细胞接种到96孔板,待细胞贴壁后,将细胞和不同药物浓度(10、50、100和500 nmol/L及1、5、10和100 μmol/L)的Tat-Smac N7共培养24 h。WST-1作用4 h后使用多功能酶标仪450 nm波长检测细胞存活率。在相当大浓度范围(10 nmol/L~100 μmol/L)内的Tat-Smac N7对EC109细胞和H460细胞的毒性很弱,在100 mmol/L的浓度时对细胞的生长抑制率仅仅是10%~20%。
3. Tat-Smac N7对两种肿瘤细胞系的辐射增敏作用:取对数生长期H460和EC109分为单纯照射组、照射联合Tat-Smac N7组,单纯照射组给予0、2、4、6 Gy照射,照射联合Tat-Smac N7组中Tat-Smac N7的浓度为20 μmol/L。结果表明示于图 2。由图 2可见,Tat-Smac N7能够增强H460和EC109细胞的辐射敏感性(F=22.2、 13.2,P<0.05)。
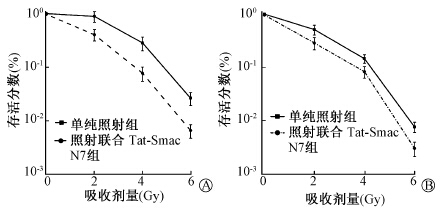 | 图 2 Tat-Smac N7对H460(A)和EC109(B)细胞辐射敏感性的影响 |
4.Tat-Smac N7在体外对辐射诱导的细胞凋亡的影响:为了观察Tat-Smac N7融合蛋白对辐射诱导的细胞凋亡的影响,取对数生长期H460和EC109细胞分为对照组,Tat-Smac N7组,单纯照射组,照射联合Tat-Smac N7组,吸收剂量为4 Gy,Tat-Smac N7浓度为20 μmol/L,Tat-Smac N7与EC109和H460细胞共培养,24 h后给予4 Gy γ射线照射,照后24、48 h收获细胞,Annexin V和PI双染法检测细胞凋亡,每组实验重复3次。照射联合Tat-Smac N7可明显增加辐射诱导的细胞凋亡率(EC109 24 h:F=5.86,P<0.05; EC109 48 h: F=8.25,P<0.05;H460 24 h: F=9.32,P<0.05; EC109 48 h: F=7.09,P<0.05)。Tat-Smac N7联合照射后凋亡诱导效应具有时间依赖性,见表 1。
| 表 1 两种细胞在24和48 h的细胞凋亡率(%,x±s) |
促凋亡蛋白Smac的发现使人们认识到,通过活化Smac或者增加Smac的表达来诱导肿瘤细胞的凋亡,成为治疗肿瘤的新思路。大量研究表明,Smac蛋白可通过促进细胞凋亡和影响肿瘤细胞生长周期发挥其抗肿瘤作用[11, 12]。人工合成的Smac肽可以有效地激活Caspase-3[13],并且可以促进肿瘤细胞凋亡的敏感性。所以,将Smac与肿瘤的放化疗、生物治疗等结合起来,将会明显提高肿瘤细胞对凋亡的敏感性[14, 15],成为肿瘤治疗新的研究方向。
本研究中把Smac蛋白中最小的活性单位Smac N7与Tat蛋白中既有穿膜特性又无细胞毒性的最小片断连接[16],合成一种新的Smac模拟物Tat-Smac N7融合肽。研究发现,该融合肽在引导肽的作用下可以顺利进入肿瘤细胞,解决了Smac N7分子不能进入细胞的问题。克隆形成实验结果表明,给予Tat-Smac N7融合肽的联合组,两种肿瘤细胞存活率均明显低于单纯照射组,而且随着照射剂量的增加,细胞存活率明显降低。另外,照射联合Tat-Smac N7组可明显增加辐射诱导的肿瘤细胞凋亡,而且其凋亡诱导效应具有时间依赖性,在联合照射后24和48 h,两种肿瘤细胞凋亡率明显高于单纯照射组,说明Tat可以成功将Smac N7引导带入肿瘤细胞内,Tat-Smac N7融合肽在细胞内发挥了促凋亡活性。
综上所述,肿瘤的辐射抗性一直是临床放疗过程中的难题。本研究合成的新型Smac模拟物Tat-Smac N7融合肽具有明显的肿瘤辐射增敏作用。随着研究的不断深入,如果Tat-Smac N7融合肽能够进行产业化生产并应用于临床,必将大大提高肿瘤的放疗疗效,改善患者的生存质量,并产生较大的社会和经济效益。
| [1] | Eyrisch S, Medina-Franco JL, Helms V. Transient pockets on XIAP-BIR2: toward the characterization of putative binding sites of small-molecule XIAP inhibitors[J]. J Mol Model, 2011, 18(5): 2031-2042. |
| [2] | Altieri DC. Survivin and IAP proteins in cell-death mechanisms[J]. Biochem J, 2010, 430 (2): 199-205. |
| [3] | Gill C, Dowling C, O'Neill AJ, et al. Effects of cIAP-1, cIAP-2 and XIAP triple knockdown on prostate cancer cell susceptibility to apoptosis, cell survival and proliferation[J]. Mol Cancer, 2009, 8: 39. |
| [4] | Qin S, Yang C, Li S, et al. Smac: Its role in apoptosis induction and use in lung cancer diagnosis and treatment[J]. Cancer Lett, 2012, 318(1):9-13. |
| [5] | Liu JJ, Guo YW, Fang ZG, et al. Activation of peroxisome proliferator-activated receptor-gamma induces apoptosis on acute promyelocytic leukemia cells via downregulation of XIAP[J]. Int J Mol Med, 2009, 24(5):623-632. |
| [6] | Ohnishi K, Nagata Y, Takahashi A, et al. Effective enhancement of X-ray-induced apoptosis in human cancer cells with mutated p53 by siRNA targeting XIAP[J]. Oncol Rep, 2008, 20(1): 57-61. |
| [7] | Anguiano-Hernandez YM, Chartier A, Huerta S. Smac/DIABLO and colon cancer[J]. Anticancer Agents Med Chem, 2007, 7(4):467-473. |
| [8] | 郭艳婷,张鹏飞,刘强. Smac与肿瘤放射治疗[J]. 国际放射医学核医学杂志, 2013,37(5): 309-313. |
| [9] | Kamide K, Nakakubo H, Uno S, et al. Isolation of novel cell-penetrating peptides from a random peptide library using in vitro virus and their modifications[J]. Int J Mol Med, 2010, 25(1): 41-51. |
| [10] | Loeder S, Drensek A, Jeremias I, et al. Small molecule XIAP inhibitors sensitize childhood acute leukemia cells for CD95-induced apoptosis[J]. Int J Cancer, 2010, 126(9): 2216-2228. |
| [11] | Li R, Rüttinger D, Urba W, et al. Targeting and amplification of immune killing of tumor cells by pro-Smac[J]. Int J Cancer, 2004, 109(1): 85-94. |
| [12] | McNeish IA, Bell S, McKay T, et al. Expression of Smac/DIABLO in ovarian carcinoma cells induces apoptosis via a caspase-9-mediated pathway[J]. Exp Cell Res, 2003, 286(2): 186-198. |
| [13] | Wu G, Chai J, Suber TL, et al. Structural basis of IAP recognition by Smac/DIABLO[J]. Nature, 2000, 408(6815): 1008-1012. |
| [14] | Fandy TE, Shankar S, Srivastava RK. Smac/DIABLO enhances the therapeutic potential of chemotherapeutic drugs and irradiation, and sensitizes TRAIL-resistant breast cancer cells[J]. Mol Cancer, 2008, 7: 60. |
| [15] | Mao HL, Liu PS, Zheng JF, et al. Transfection of Smac/DIABLO sensitizes drug-resistant tumor cells to TRAIL or paclitaxel-induced apoptosis in vitro[J]. Pharmacol Res, 2007, 56(6): 483-492. |
| [16] | BECker-Hapak M, McAllister SS, Dowdy SF. TAT-mediated protein transduction into mammalian cells[J]. Methods, 2001, 24(3): 247-256. |
 2015, Vol. 35
2015, Vol. 35