神经上皮细胞转化基因1 (neuroepithelial cell transforming gene 1,Net1)是RhoA GTP酶的一种特异性鸟苷酸交换因子(guanine nucleotide exchange factors,GEFs)[1]。RhoA GTP酶是所有Rho GTP酶超家族成员中被研究得最多的小G蛋白之一,它同Rho家族的所有成员一样在与GTP结合的活化型和与GDP结合的失活型两种构象之间循环[2]。Net1的作用就是催化RhoA 释放GDP并结合GTP,从而活化RhoA GTP酶。RhoA参与调控细胞中的许多信号通路,主要调节细胞骨架的动态变化、基因表达、细胞周期、细胞转化等[3]。RhoA及其GEFs在细胞中的定位是决定其在不同信号通路中发挥作用的重要因素之一[4]。绝大多数RhoA及其GEFs都位于细胞质中,目前仅发现RhoA的2种GEFs具有核定位序列,即Net1和Ect2主要位于细胞核中[1, 5]。有研究发现,在正常状态下,一部分RhoA位于细胞核中,当细胞受到电离辐射刺激后,定位于细胞核中的Net1可以激活核中的RhoA[6, 7]。本研究采用实时荧光定量PCR(real-time quantitative PCR,qPCR)和免疫共沉淀(co-immunoprecipitation,Co-IP)等分子生物学技术,从分子水平上研究了Net1在细胞受到电离辐射损伤后的反应及可能的作用机制。
1. 材料和试剂:DMEM培养基和胎牛血清购自美国GIBCO公司,RNasey Mini试剂盒及QuantiTect反转录试剂盒均购自德国Qiagen公司,SYBRGreen预混合物购自瑞士Roche公司,Lipofectamine RNAi MAX和Lipofectamine 2000转染试剂购自美国Life Technologies公司,Net1抗体购自英国Abcam公司,Ku70、Ku80和DNA-PKcs抗体均购自美国Neomarkers公司,HA抗体购自美国Santa Cruz公司,β-肌动蛋白抗体购自北京康为世纪生物科技有限公司,辣根过氧化酶标记的二抗购自北京中杉金桥生物技术有限公司。
2. 细胞培养:人宫颈癌HeLa细胞由天津市放射医学与分子核医学重点实验室保存。细胞在含10%胎牛血清的DMEM培养基中,37℃、5%CO2、饱和湿度的条件下培养。
3. 照射条件:γ射线照射采用 137Cs源(加拿大原子能公司,γ-Cell 40),剂量率为1 Gy/min。
4. qPCR检测Net1 mRNA水平:提取细胞中的总RNA,将mRNA反转录成cDNA。使用Roche的SYBR Green预混合物,按说明书要求添加引物和模板,每个PCR反应的总体积为20 μl。qPCR反应程序:95℃ 10 min激活DNA聚合酶;然后95℃ 15 s,60℃ 30 s,共40个循环;熔解曲线程序为机器默认设置。qPCR反应中所用引物:Net1引物:5'GCTGACTCGGTGTGGATTGATTGG 3',5'CGAAGGGTAAATGACTGTATTGTTTGACC 3';GAPDH引物:5'GGAAGGTGAAGGTCGGAGTC 3',5'GCTCCTGGAAGATGGTGATG 3'。
5. 小RNA干扰特异性沉默内源性Net1表达:非特异的阴性对照siRNA和Net1 siRNAs均由上海吉玛生物有限公司合成。Net1 siRNA1的序列为5' GGAGGAUGCUAUAUUGAUA 3'; Net1 siRNA2的序列为5' UCUCUCCUGUAAGAAAUGG 3'。转染试剂为Lipofectamine RNAi MAX,具体步骤如下:转染前1 d使用不含抗生素的培养基,将细胞接种到6孔板中,使细胞密度在转染时大约达到40%。转染时,取50 pmol的siRNA用250 μl无血清无抗生素的OPTI-MEM培养基稀释混匀,另取4 μl的Lipofectamine RNAi MAX也用250 μl同样的培养基稀释混匀,5 min后将以上两部分混合,室温孵育20 min,将全部500 μl混合物滴加入6孔板中,轻轻混匀。
6. 细胞克隆形成:阴性对照siRNA或者Net1特异siRNA转染至HeLa细胞后48 h,细胞接受4 Gy的γ射线照射,照射4 h后的细胞接种到10 cm培养皿中,每种细胞接种3个培养皿。在37℃、5% CO2培养箱中培养至克隆形成,用含0.25%结晶紫的乙醇固定细胞并给细胞染色,晾干拍照,并计数大于50个细胞的克隆数。实验重复3次。克隆形成率(%)=细胞克隆数/接种细胞数×100%。
7. Western blot:裂解细胞,提取总蛋白,测定总蛋白浓度。取40 μg总蛋白上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,采用半干转移法将蛋白转移到硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h,于4℃一抗孵育过夜,室温二抗孵育1 h,加显色剂显色曝光。
8. 免疫共沉淀(Co-IP):由于Net1抗体不能用于Co-IP,于是将带有HA标签的Net1表达质粒HA-Net1用Lipofectamine 2000转染至HeLa细胞,使细胞过表达HA-Net1,但是过表达HA-Net1的HeLa细胞接受20 Gy照射后存活率低,不适合进行接下来的Co-IP实验,因此,将吸收剂量降低到10 Gy来照射细胞。转染48 h后10 Gy照射细胞,照射后分不同时间点收集细胞,用放射免疫沉淀试验(RIPA)缓冲液裂解细胞,离心半径10 cm,12 000 r/min,离心10 min取上清,在上清中加入HA抗体,于4℃与抗原结合过夜,然后加入蛋白A/G琼脂糖珠吸附2 h,3 000 r/min,离心半径10 cm,4℃离心1 min,去上清,用RIPA 缓冲液清洗沉淀物3次,每次10 min。 最后在沉淀中加入蛋白上样缓冲液,煮沸10 min,进行SDS-PAGE和Western blot分析。
9. 统计学处理:结果用x±s表示。采用SPSS 11.5统计软件,用独立样本t检验对mRNA表达水平、细胞克隆形成率进行分析。P<0.05为差异有统计学意义。
1.电离辐射对Net1 mRNA表达的影响:通过qPCR检测Net1 mRNA水平的变化发现,与没有受到电离辐射的对照组相比,接受20 Gy照射的HeLa细胞中Net1 mRNA相对量升高了(2.69±0.21)倍(t=-10.52,P<0.05),说明在受到大剂量电离辐射照射后Net1基因的表达水平会增高。
2.siRNA特异沉默Net1基因的表达:转染两种不同的Net1特异siRNA到HeLa细胞中,48 h后收集细胞,用Western blot检测最终的Net1蛋白水平,发现两种Net1 siRNA 都能有效地沉默HeLa细胞中Net1基因的表达(图 1)。
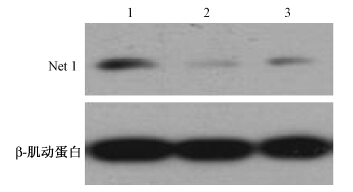 | 注:Net 1:神经上皮细胞转化基因1;1. 阴性对照siRNA;2. Net1 siRNA1;3.Net1 siRNA2图 1 Western blot检测Net1蛋白水平 |
3.Net1对细胞辐射敏感性的影响:通过细胞克隆形成实验检测Net1对4 Gy γ射线照射后细胞辐射敏感性的影响。在细胞未受到照射时,Net1 siRNA1与阴性对照siRNA对细胞克隆形成的影响相差无几;然而当细胞受到4 Gy γ射线照射后,转染了Net1 siRNA的细胞形成克隆的能力明显减弱。采用两种不同Net1 siRNA(Net1 siRNA1和Net1 siRNA2)转染细胞,结果表明,转染阴性对照siRNA的细胞存活率为(13.60±1.16)%,转染Net1 siRNA1的细胞存活率为(3.37±0.71)%,转染Net1 siRNA2的细胞存活率为(5.79±0.82)%。与阴性对照siRNA相比,Net1 siRNA1和Net1 siRNA2均显著降低4 Gy照射后的细胞存活率(t=15.31、11.65,P<0.05),说明Net1基因沉默的HeLa细胞对4 Gy的电离辐射敏感性显著增强。
4.Net1与DNA修复蛋白的相互作用:Co-IP结果发现(图 2),当细胞中有HA-Net1稳定表达时,HA抗体可以沉淀下HA-Net1以及参与DNA双链断裂非同源末端连接修复的几个关键蛋白——Ku70、Ku80和DNA-PKcs,无论在正常状态下还是在细胞受到照射后;而在转入空载体的细胞中,HA抗体既不能与Net1相结合,也不能与Ku70、Ku80和DNA-PKcs相互作用。为了进一步验证Net1与Ku70的相互作用,在Co-IP实验中用Ku70抗体沉淀细胞中的内源性Ku70,发现其仍然可以结合内源性的Net1(图 3),说明Net1与Ku70确实存在相互作用,提示Net1可能参与或调控非同源末端连接修复途径。
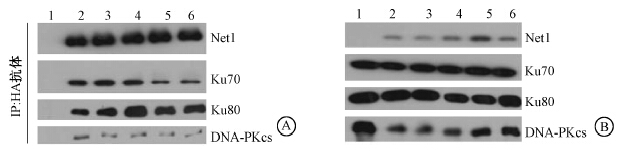 | 注:1.细胞中转入空载体,未照射;2.细胞中转入HA-Net1,未照射;3~6.细胞中转入HA-Net1,10 Gy照射后0.5、1、2、4 h图 2 免疫共沉淀检测Net1结合蛋白 A. IP样品显示结合的蛋白;B.细胞裂解物显示细胞中存在的蛋白 |
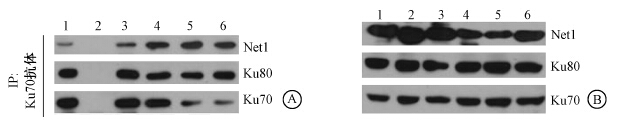 | 注:1.未照射;2.未照射,Co-IP中加入IgG代替Ku70抗体作为阴性对照;3~6. 10 Gy照射后0.5、1、2、4 h图 3 免疫共沉淀验证Net1与Ku70的相互作用 A. IP样品显示结合的蛋白;B.细胞裂解物显示细胞中存在的蛋白 |
Net1是位于细胞核中的RhoA GTP酶特异性的GEFs[2],在细胞受到DNA损伤后会导致Net1激活RhoA[8]。以往认为Net1在细胞核中是没有活性的,只有转移到细胞质中才能激活RhoA蛋白[1]。然而,近期Dubash等[6]研究发现,Net1在细胞核中具有活性,当细胞受到电离辐射刺激后,Net1能在细胞核中直接激活RhoA。而且,本课题组前期工作已经通过慢病毒介导的Net1 shRNA稳定降低细胞中Net1的表达,使得细胞对电离辐射的敏感性显著增强,并且辐射后凋亡细胞数增加,表明Net1在电离辐射损伤反应中具有保护细胞的重要生物学功能[9]。但是Net1在电离辐射损伤反应中的作用机制尚不清楚。因此本研究进一步在分子水平上探索Net1的作用机制。
首先,运用实时荧光定量PCR测定Net1 mRNA水平,发现辐射后Net1 mRNA表达量显著上升,进一步说明Net1可能在电离辐射损伤反应中具有重要生物学功能。但是,Net1蛋白水平却没有在受到辐照后显著增加。这有两种可能性:一是由于存在mRNA转录后调控和蛋白质翻译调控,可能mRNA转录增强后又受到其他信号调节降解了mRNA或者停止了蛋白质翻译,从而降低了蛋白质的合成;二是照射条件的差异,20 Gy γ射线照射后Net1 mRNA水平显著升高,而Net1蛋白水平是在细胞受到10 Gy照射后用Western blot检测的,可能需要大剂量照射才能诱导Net1蛋白水平的升高,这有待进一步研究。
其次,本课题组以往工作已经采用Net1 shRNA敲降细胞中的内源性Net1,发现细胞的敏感性显著增强[9],但是当时没有适用于Western blot的Net1抗体,所以没有检测敲降后的Net1蛋白水平,并且siRNA比shRNA能更有效地敲降内源性Net1,因而利用siRNA特异性沉默Net1后,用克隆形成实验再次验证当细胞中缺少Net1时,细胞对辐射的敏感性明显增强。
另外,DNA双链断裂是电离辐射所导致的最主要DNA损伤类型,也是基因突变、染色体畸变和细胞死亡的主要原因之一[10]。在真核生物中,修复DNA双链断裂主要有两种途径:同源重组和非同源末端连接[11]。Net1在电离辐射损伤反应中能保护细胞,其机制是否与DNA双链断裂修复有关,本研究采用免疫共沉淀技术检测是否有DNA损伤修复蛋白与Net1相互作用来回答这个问题。结果发现非同源末端连接途径中的3个关键蛋白(Ku70、Ku80和DNA-PKcs)都能与Net1相互作用,并且在照射后的1 h之内,Net1与Ku70、Ku80的结合量似乎有所增加,说明Net1很可能参与或调控非同源末端连接修复信号通路。由于以前的实验结果显示Net1在电离辐射损伤反应中具有保护细胞的重要作用,因此,根据本研究结果可以推断缺失Net1可能导致非同源末端连接修复信号通路受阻,从而使得DNA损伤修复效率降低,凋亡细胞数增加。
综上所述,本研究表明Net1在电离辐射损伤反应中与非同源末端连接修复蛋白相互作用来发挥保护细胞的重要生物学功能,具体的作用机制需进一步深入研究。
| [1] | Schmidt A, Hall A. The Rho exchange factor Net1 is regulated by nuclear sequestration[J]. J Biol Chem, 2002, 277(17):14581-14588. |
| [2] | Rossman KL, Der CJ, Sondek J. GEF means go: turning on RHO GTPases with guanine nucleotide-exchange factors[J]. Nat Rev Mol Cell Biol, 2005, 6(2):167-180. |
| [3] | Hall A. Rho GTPases and the control of cell behaviour[J]. Biochem Soc Trans, 2005, 33(Pt5): 891-895. |
| [4] | Mor A, Philips MR. Compartmentalized Ras/MAPK signaling[J]. Annu Rev Immunol, 2006, 24: 771-800. |
| [5] | Chalamalasetty RB, Hümmer S, Nigg EA, et al. Influence of human Ect2 depletion and overexpression on cleavage furrow formation and abscission[J]. J Cell Sci, 2006, 119(Pt14): 3008-3019. |
 2015, Vol. 35
2015, Vol. 35


