2. 徐州市肿瘤医院
神经源性分化因子(NeuroD),也称为BETA2 (β-cell E-box Trans-activator 2,BETA2),属于bHLH家族,是具有bHLH结构域的转录调控因子[1]。NeuroD基因定位于人染色体2q32位点,主要在神经、胃肠道和胰腺细胞中表达,其调控多个组织器官的发育和成熟过程[2, 3]。NeuroD蛋白具有调节各种干细胞向终末细胞分化的能力[4],可以促进胰岛干细胞分化成为胰岛α、β、δ和PP细胞[5]。当缺乏NeuroD时,小鼠将会出现小脑神经元、内耳感觉神经元及视网膜感光细胞的缺失[6],小鼠胰腺缺乏NeuroD将会导致内、外分泌腺发育不完全[7]。 NeuroD蛋白本身具有蛋白质转导结构域(protein transduction domain,PTD),自身可以高效的穿过细胞膜进入真核细胞中[8]。同时NeuroD是胰岛素转录的重要调控因子[9, 10],外源性NeuroD蛋白腹腔注射后可转导进入小肠组织,促使肠上皮细胞分泌胰岛素,用来治疗糖尿病小鼠[11],但对其在放射性肠损伤中作用的研究未见报道。本研究将构建带有EGFP荧光蛋白的NeuroD-EGFP融合蛋白,用来追踪NeuroD蛋白的分布情况,同时建立小鼠放射性肠损伤模型,并在照射后腹腔内注射NeuroD-EGFP融合蛋白,观察各项指标,探索NeuroD蛋白在放射性肠损伤中的作用,旨在为放射性肠损伤的临床救治寻求新的方法。
1.材料和试剂:各种限制性内切酶和T4-DNA连接酶购自上海赛百盛基因技术有限公司,pET-32a载体,Ni-NTA柱和BL21(DE3)购自美国Novagen公司,异丙基硫代半乳糖苷IPTG购自上海生工生物技术有限公司,人结肠癌细胞(RKO)购自中国科学院上海生命科学研究院细胞资源中心,DMEM购自美国Hyclone公司,血清购自美国GIBCO公司。
2.NeuroD-EGFP融合蛋白的构建、表达和纯化:PCR扩增的全长NeuroD序列经BamHI和SalI酶切回收,PCR扩增的绿色荧光蛋白(EGFP)序列经SalI和NotI酶切回收,原核表达载体pET-32a经BamHI和NotI酶切回收5.9 kb片段;然后将3个片段连接。将上述质粒转入BL21(DE3)感受态原核表达菌株,形成稳定的高表达菌株。在Luria-Bertani平板(LB平板)上划单菌落,挑取单菌落至3 ml LB培养液中放大培养,于37℃、200 r/min摇床培养4~5 h,异丙基硫代半乳糖苷(IPTG)诱导12 h。收集细菌,超声裂菌,使用Ni-NTA柱纯化融合蛋白。
3.NeuroD-EGFP融合蛋白体外进入细胞实验:PKO细胞培养,培养基为DMEM,含10%胎牛血清,于37℃、5%CO2培养箱中培养。将RKO细胞以1×104孔接种96孔板中,孵育24 h。分3组,分别加入PBS、1 μmol/L EGFP、1 μmol/L NeuroD-EGFP融合蛋白,作用5 h后,PBS冲洗3次,荧光倒置显微镜下观察。
4.实验动物及分组:8周龄C57BL/6J小鼠(上海斯莱克实验动物有限公司)40只,体重23~26 g。饲养条件符合国家标准的普通环境,温度控制于20~22℃,湿度50%,普通光照6:00—18:00。将小鼠采用随机数字表法分为正常对照组、PBS组、EGFP组和NeuroD-EGFP组,每组10只。
5.放射性肠损伤动物模型制作:以60Co γ射线对小鼠进行全身照射,吸收剂量率为200 cGy/min,3组小鼠吸收剂量均为9 Gy。各组于照射后立即进行腹腔注射,3组分别注射100 μl PBS、EGFP(0.1 mmol/L)、NeuroD-EGFP融合蛋白(0.1 mmol/L)。
6.检测指标:照射后5 h,分别取EGFP组、NeuroD-EGFP组小鼠1只,脱颈椎处死后取全长卷肠,制备冰冻组织切片,荧光显微镜下观察NeuroD-EGFP融合蛋白在小肠组织中分布情况。在照射后6 h和3.5、7 d,分别取各实验组小鼠3只,脱颈椎处死后迅速打开腹腔,取全长卷肠,使用4%多聚甲醛固定24 h,石蜡包埋切片,HE染色,置于光镜下观察小肠肠道形态学病理变化并拍照。使用Image J图像分析软件随机全盲测量小肠绒毛高度、隐窝深度,并计数隐窝数目。
7.统计学处理:结果用x±s表示。采用SPSS 19.0 统计软件进行处理,ANOVA法检验分析多个样本均数间的差异,LSD法进行多个样本均数间的多重比较。P<0.05为差异有统计学意义。
1. 融合蛋白的表达和纯化:由图 1可以看出,收集菌体超声波破碎后,全菌蛋白用SDS-PAGE蛋白凝胶电泳进行分析,加入IPTG诱导(2号条带)之后,与未加入IPTG(1号条带)对比可见有一条明显的表达条带。经过Ni-NTA柱纯化后,SDS-PAGE上进行蛋白电泳分析,证明纯化得到了NeuroD蛋白与EGFP的融合蛋白,符合预期相对分子质量大小。
 | 注:A图中,M. Marker;1. 未加入IPTG诱导时的全菌蛋白;2. 加入IPTG诱导后的全菌蛋白;B图中,M. Marker;1. 经过Ni-NTA柱纯化后的蛋白图 1 NeuroD-EGFP融合蛋白的表达及纯化 A. 收集菌体超声波破碎后的全菌蛋白进行蛋白电泳; B. 对经过Ni-NTA柱纯化的蛋白进行蛋白电泳 |
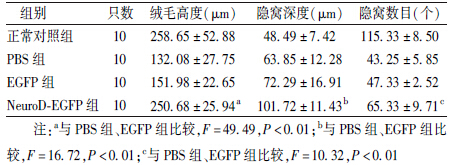
2. NeuroD-EGFP融合蛋白可转导进入细胞内:由图 2可以看出,加入PBS或EGFP培养的细胞中,荧光倒置显微镜下未观察到绿色荧光。然而,在加入NeuroD-EGFP融合蛋白培养的细胞中,可见有绿色荧光聚集在细胞内部,说明NeuroD-EGFP融合蛋白可穿过细胞膜进入细胞内,且进胞效率较高。
 | 图 2 NeuroD-EGFP融合蛋白体外转导进细胞实验×400 A、B.加入PBS培养5 h后; C、D.加入EGFP培养5 h后; E、F.加入NeuroD-EGFP融合蛋白培养5 h后 |
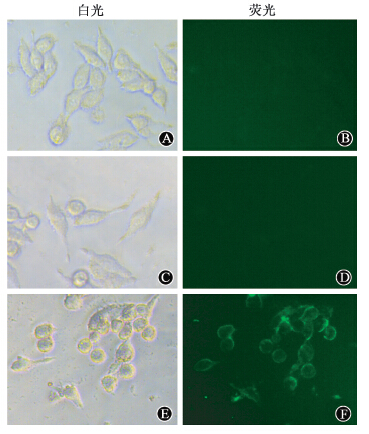
3. NeuroD-EGFP融合蛋白体内转导进入小肠组织:由图 3可以看出,腹腔注射EGFP的小鼠小肠组织中,荧光显微镜下未观察到绿色荧光。然而,在腹腔注射NeuroD-EGFP融合蛋白的小肠组织中,可见有绿色荧光聚集在小肠绒毛上皮细胞内部,说明NeuroD-EGFP融合蛋白可在体内转导进入小肠组织中。
 | 图 3 NeuroD-EGFP融合蛋白体内转导进入小肠组织实验×400 A、B. 腹腔注射EGFP 5 h后; C、D. 腹腔注射NeuroD-EGFP融合蛋白5 h后 |
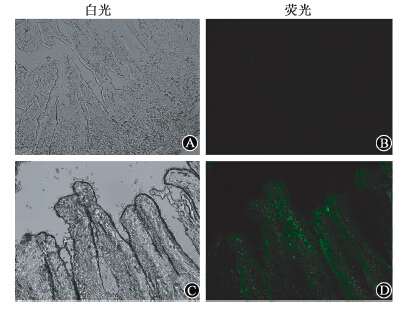
4. NeuroD-EGFP融合蛋白对小鼠肠道组织的保护作用:9 Gy γ射线全身照射后3组小鼠6 h、3.5、7 d均见肠绒毛脱落,在照射后3.5 d最为明显。 由图 4可以看出,HE染色后光镜下观察,可见PBS及EGFP组小鼠肠道组织绒毛脱落严重,稀疏,NeuroD-EGFP组绒毛仍较为丰富。与PBS及EGFP组相比(表 1),NeuroD-EGFP组绒毛高度较高(F=49.49,P<0.01),隐窝深度较高(F=16.72,P<0.01),同时肠隐窝数目较多(F=10.32,P<0.01),表明NeuroD蛋白能够促进辐射后小肠隐窝的增生修复,减少绒毛的脱落。
 | 图 4 9 Gy γ线照射后3.5 d小鼠肠道组织的病理变化 HE染色 ×100 A. 正常对照组;B. PBS组;C. EGFP组;D. NeuroD-EGFP组 |
| 表 1 γ射线全身照射后3.5 d小肠绒毛高度、隐窝深度及隐窝数目比较(x±s) |
本研究中,根据构建的NeuroD-EGFP融合蛋白的绿色荧光分布来示踪目的蛋白在组织及细胞内的分布和定位,结果表明,NeuroD-EGFP融合蛋白在体外及体内均可穿过细胞膜,进入细胞内。随后建立了C57BL/6J小鼠放射性肠损伤动物模型,观察到NeuroD-EGFP融合蛋白对肠道的治疗作用在照射后第3.5天最为明显,NeuroD-EGFP融合蛋白促进了肠道隐窝的增生,并能减轻放射线引起的肠道绒毛的坏死、脱落,保护了肠道的组织结构,由此表明NeuroD蛋白具有治疗急性放射性肠损伤的作用。
小肠上皮更新速度较快,同时对射线较敏感,极易发生放射性损伤。射线可引起肠隐窝细胞增殖抑制,使肠上皮缺乏更新来源,从而导致肠上皮完整性遭到破坏,肠道的分泌、吸收及屏障功能受损[12]。NeuroD蛋白具有调节各种干细胞向终末细胞分化的作用,并能使其处于持续增殖状态,其对放射性肠损伤的治疗作用,可能与其能促进隐窝干细胞的分化增殖相关。NeuroD蛋白能够使肠隐窝干细胞不断分化,补充照射后生长抑制的肠上皮细胞,保证肠道上皮的完整性,进而保护了肠道的结构和功能。但NeuroD作为转录因子,进入细胞后能直接启动哪些下游基因的表达需要进一步的研究。
NeuroD蛋白可在电离辐射后进行给药,并表现出较好的治疗效果,与传统抗辐射药物需要照射前给药相比,存在一定的优势[13]。因此,在核事故、核意外等突发情况下,NeuroD蛋白具有潜在的临床应用价值。同时,NeuroD蛋白具有自身转导活性,腹腔给药后可高效进入肠道组织,并能保持生物学活性。此种蛋白质治疗的方式避免了外源性基因导入的不可控性,消除了治疗的风险,具有瞬时作用、可控性强的优点。
综上,NeuroD蛋白对小肠绒毛及隐窝有治疗作用,减轻了放射性肠损伤,且其在照射后给药依然能发挥作用,但NeuroD蛋白的具体作用机制,照射前给药是否会对放射性肠损伤有预防作用,及最佳给药时间等问题有待进一步研究。
| [1] | Lee JE, Hollenberg SM, Snider L, et al. Conversion of Xenopus ectoderm into neurons by NeuroD, a basic helix-loop-helix protein[J]. Science, 1995, 268(5212): 836-844. |
| [2] | Mastracci TL, Anderson KR, Papizan JB, et al. Regulation of Neurod1 contributes to the lineage potential of Neurogenin3+ endocrine precursor cells in the pancreas[J]. PLoS Genet, 2013, 9(2): e1003278. |
| [3] | Ochocinska MJ, Muñoz EM, Veleri S, et al. NeuroD1 is required for survival of photoreceptors but not pinealocytes: results from targeted gene deletion studies[J]. J Neurochem, 2012, 123(1): 44-59. |
| [4] | Brazelton TR, Rossi FM, Keshet GI, et al. From marrow to brain: expression of neuronal phenotypes in adult mice[J]. Science, 2000, 290(5497): 1775-1779. |
| [5] | Kaneto H, Matsuoka TA, Katakami N, et al. Combination of MafA, PDX-1 and NeuroD is a useful tool to efficiently induce insulin-producing surrogate beta-cells[J]. Curr Med Chem, 2009, 16(24): 3144-3151. |
| [6] | Liu M, Pereira FA, Price SD, et al. Essential role of BETA2/NeuroD1 in development of the vestibular and auditory systems[J]. Genes Dev, 2000, 14(22): 2839-2854. |
| [7] | Malecki MT, Jhala US, Antonellis A, et al. Mutations in NEUROD1 are associated with the development of type 2 diabetes mellitus[J]. Nat Genet, 1999, 23(3): 323-328. |
| [8] | Chen J, Li G, Lu J, et al. A novel type of PTD, common helix-loop-helix motif, could efficiently mediate protein transduction into mammalian cells[J]. Biochem Biophys Res Commun, 2006, 347(4): 931-940. |
| [9] | Gu C, Stein GH, Pan N, et al. Pancreatic beta cells require NeuroD to achieve and maintain functional maturity[J]. Cell Metab, 2010, 11(4): 298-310. |
| [10] | Kaneto H, Nakatani Y, Miyatsuka T, et al. PDX-1/VP16 fusion protein, together with NeuroD or Ngn3, markedly induces insulin gene transcription and ameliorates glucose tolerance[J]. Diabetes, 2005, 54(4): 1009-1022. |
| [11] | Huang Y, Chen J, Li G, et al. Reversal of hyperglycemia by protein transduction of NeuroD in vivo[J]. Acta Pharmacol Sin, 2007, 28(8): 1181-1188. |
| [12] | François A, Milliat F, Jullien N, et al. Radiotherapy: what therapeutic orientations against the digestive aftereffects?[J]. Med Sci(Paris), 2009, 25(3): 267-272. |
| [13] | Kouvaris J, Kouloulias V, Kokakis J, et al. The cytoprotective effect of amifostine in acute radiation dermatitis: a retrospective analysis[J]. Eur J Dermatol, 2002, 12(5): 458-462. |
 2015, Vol. 35
2015, Vol. 35